TDP-43誘導ALSモデルマウス
TAR DNA結合タンパク質(TARDBPまたはTDP-43)は、増え続ける神経変性疾患において重要な役割を果たしていることが示されている。 散発性および家族性の筋萎縮性側索硬化症(ALS)に強く関連している一方で、TDP-43の神経細胞内蓄積と凝集は、前頭側頭葉変性症(FTLD-TDPまたは以前のFTLD-U)にも関連している。
C57BL/6マウスにALSを誘発するために、ヒトTDP-43を発現する血清型9のアデノ随伴ウイルス(AAV)粒子(AAV9-GFP-hTDP-43)を運動皮質に注射する。 対照動物にはAAV9-GFPを注射する。 生後3ヶ月で誘導され、その後6ヶ月間追跡された動物を分析すると、AAV9-GFP-hTDP-43を注射された動物では以下のことが示された:
- 初期の筋力低下
- 学習障害
- 大脳皮質におけるhTDP-43の発現
- 活性化したミクログリアの増加
- ユビキチン化の増加
- 神経細胞の損失
筋力低下は、AAV9-GFP-hTDP-43を注射してからすでに3ヵ月後に観察される(図1)。
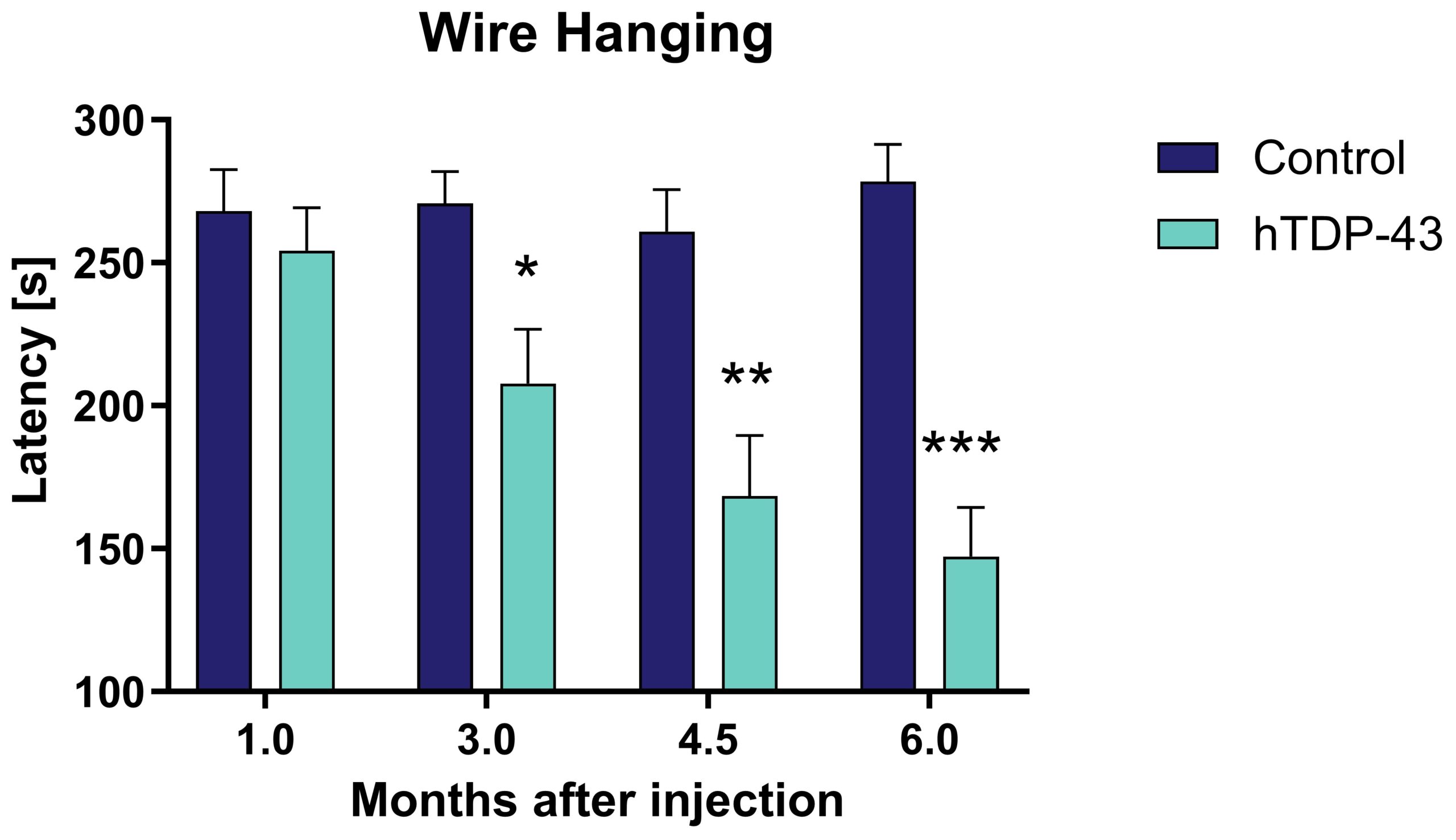
図1:AAV9-GFP-hTDP-43マウスとコントロールマウスにおけるワイヤー掛け。 ワイヤーにぶら下がるまでの時間を300秒まで測定した。 Two-Way-ANOVAとBonferronipost hoctest。 平均値+SEM。 コントロール:n=16、hTDP-43:n=20。 * p< 0.05、** p< 0.01、*** p< 0.001。
AAV9-GFP-hTDP-43を注入してから6ヵ月後、マウスは大脳皮質でhTDP-43タンパク質を発現した(図2)。
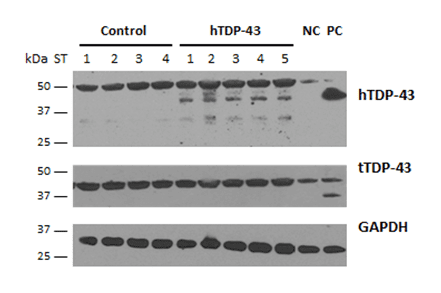
図2:コントロールマウスとhTDP-43マウスの大脳皮質におけるヒトおよび全TDP-43の発現。 AAV9-GFP-hTDP-43およびコントロールマウスの大脳皮質サンプルについて、注入6ヶ月後にRIPA緩衝液でホモジナイズし、GAPDHをローディングコントロールとして用いたウェスタンブロット解析。 PC:ポジティブコントロール=トランスジェニックTDP-43マウスの海馬RIPAサンプル。 NC:ネガティブコントロール=未処理の野生型マウス。
hTDP-43の発現と活性化ミクログリアの増加レベルは、6ヶ月後のAAV9-GFP-hTDP-43注射マウスの脳で測定可能である(図3)。
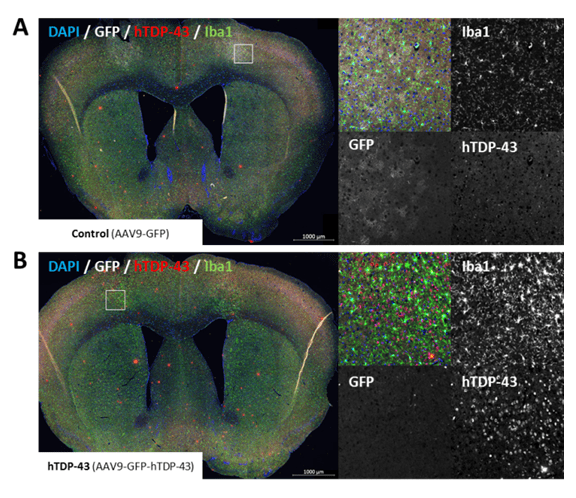
図3:コントロールマウスの脳におけるGFP(白)、ヒトTDP-43(赤)、Iba1(ミクログリアマーカー、緑)および核(DAPI、青)の免疫標識 (A)およびAAV9-GFP-hTDP-43を注入した (B). 0.62mmで冠状に切断された脳サンプル。 白い枠:注射部位を右側に拡大。 ウイルスは3ヵ月齢のマウスの運動皮質領域M1に両側から注射した。 サンプルは注射から6ヵ月後に採取した。
SCANTOXでは、お客様のご希望に沿ったALS誘発モデルの試験デザインをご提案いたします。 また、研究デザインに関するアドバイスやご提案もさせていただきます。 ウイルス誘導hTDP-43マウスは、ゆっくりと進行するALSの貴重なモデルである。 ビヒクルを注射した野生型マウスは、適切な研究デザインに必要なコントロールとして機能します。 したがって、このモデルはALSに対する潜在的な治療法の有効性を評価し、そのような治療法の時間依存的効果を観察するのに適したモデルである。
弊社では、貴社の化合物の有効性をALS誘発動物モデルで評価することを喜んでお引き受けいたします! 最も一般的な結果は以下の通りです:
