RNA結合タンパク質TDP-43は、筋萎縮性側索硬化症 (ALS)や前頭側頭葉変性症(FTLD)のような神経変性疾患と強く関連している。 いくつかの研究から、細胞質内のTDP-43凝集体がストレス顆粒マーカーと共局在することが示されている。 ストレス顆粒(SG)は、細胞ストレス時にRNAのサブセットの翻訳を抑制する細胞質封入体である。 SGの形成がTDP-43の蓄積に寄与することが示されて以来、SGの形成の阻害、および/またはTDP-43のSGへの動員は、現在ALS研究の焦点となっている経路である。
ALSをin vitroでモデル化するために、TDP-43を過剰発現した神経芽腫細胞を、よく知られているSG誘導剤である亜ヒ酸ナトリウム(SA)で処理することができる。 その後、TDP-43の凝集をproteinsimple WES技術で測定すると、SA処理によりTDP-43が可溶性から不溶性へと強くシフトすることが示された(図1)。
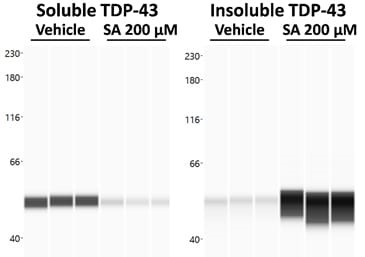
図1. 可溶性および不溶性TDP-43レベルに対する亜ヒ酸ナトリウム(SA)処理の影響。 SAまたはビヒクル処理後に細胞を採取し、可溶性タンパク質画分と不溶性タンパク質画分を分離した。 両画分をproteinsimple WESでTDP-43を分析した。 可溶性画分と不溶性画分におけるTDP-43シグナルのWESレーン図。
さらに、SG形成とTDP-43のリクルートメントを免疫細胞化学的に解析することができる(図2)。 SGマーカーであるG3BPの免疫細胞化学染色では、SA処理細胞ではビヒクルコントロールと比較してかなりのSG形成が見られるが(図2)、シクロヘキシミドはSG形成を抑制することができる(図2下段)。
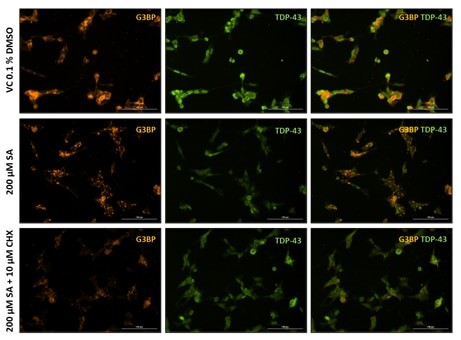
図2. ビヒクル(VC 0.1% DMSO)、200µM亜ヒ酸ナトリウム(SA)、およびSA病変+10µMシクロヘキシミド(CHX)処理したSH-TDP-43細胞をストレス顆粒マーカーG3BP(橙色)およびヒトTDP-43(緑色)で染色した代表的な画像。 スケールバー100μm。
また、TDP-43の核から細胞質への局在の変化は、WES解析または免疫細胞化学による画像ベースのどちらのアプローチでも評価できる。
