発達の過程で、ニューロンは神経突起伸長と呼ばれる軸索や樹状突起を伸ばし、他のニューロンとシナプス結合することで、機能的なネットワークを形成する。 驚くべきことに、成体脳においても、神経細胞はその成長能力とシナプス形成能力を維持している。 神経突起伸長の刺激と促進は、損傷後や神経変性疾患における神経細胞機能の回復に重要である。 アルツハイマー病やパーキンソン病などの神経変性疾患を標的とした薬剤の有望な戦略は、神経突起伸長の再生を促進することである。 したがって、新しい治療法は、神経突起伸長に影響を与える分子の同定に焦点を当てている。 この目的のために、SCANTOXは開発化合物の神経栄養効果を評価するための細胞培養モデルを提供しています。
神経突起伸長溶液1
マウス/ラットの初代海馬ニューロンまたは皮質ニューロンをDIV1に48時間化合物で処理する。 処理後、IncuCyte® label-free Live-Cell Analysis Systemを用いて神経突起伸長を経時的に評価する。 ライブセル解析と処理は、科学的な疑問に応じて延長することができる。
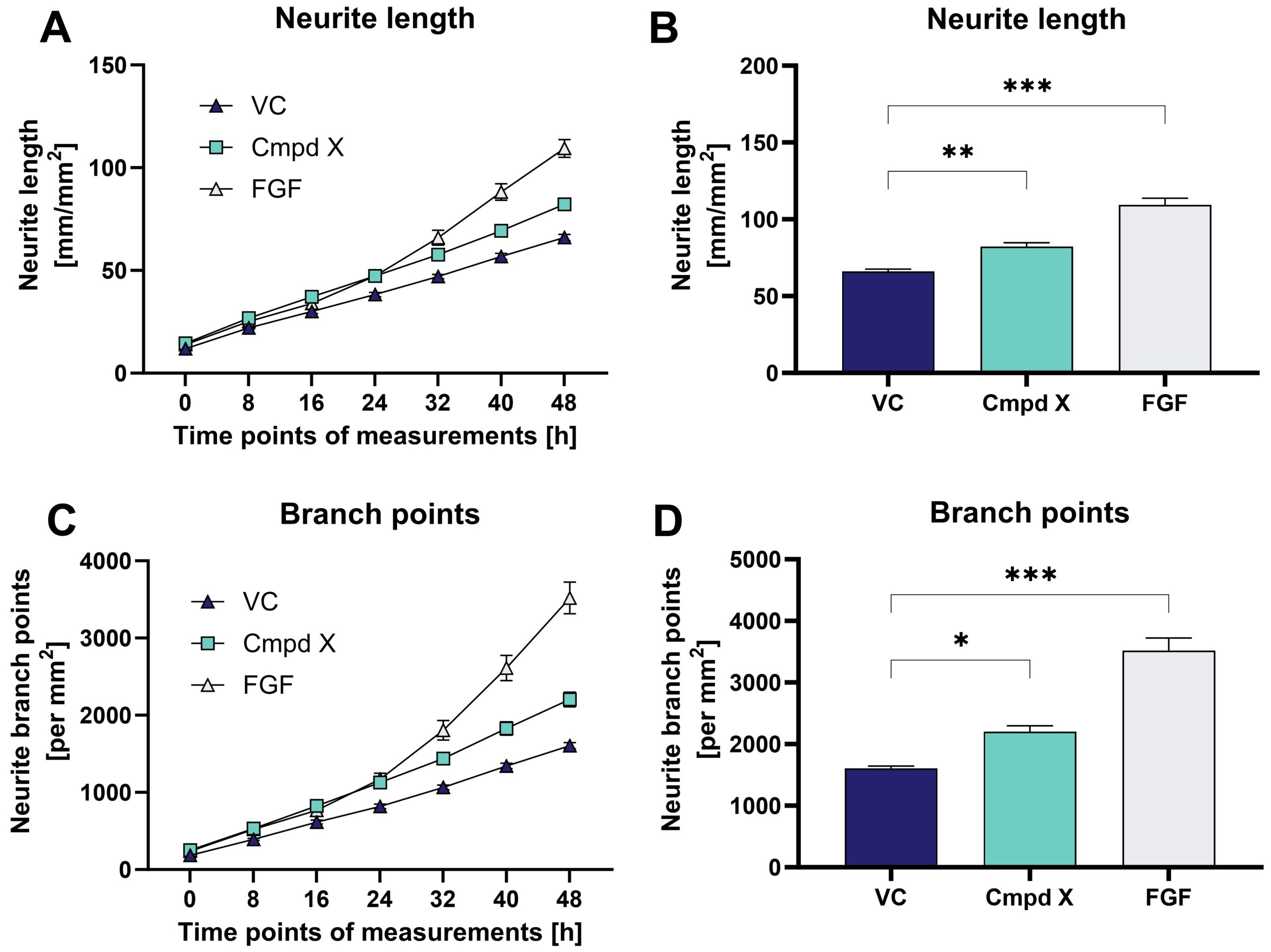
図:マウス初代海馬ニューロンの神経突起伸長と分岐に対する化合物X(Cmpd X)と線維芽細胞増殖因子(FGF)の経時的影響。
データは経時曲線(A、
C)または棒グラフ(B、
D)で表示した(n=6 /群)。
一元配置分散分析(One-way ANOVA)後、Dunnettの多重比較ポストホック検定により、ビヒクル対照(VC)と比較; *p<0.05; **p<0.01; ***p<0.001。
神経突起伸長液2
マウス/ラット初代海馬または皮質ニューロンを化合物でDIV1に48時間処理する。 細胞は、抗β-チューブリンIII抗体を用いた間接免疫蛍光分析に供され、イメージングモジュールを備えたCytation5マルチモードリーダー(Biotek社製)で、1ウェルあたり4~6枚の画像を10倍拡大でイメージングする。 自動画像ベース解析を用いて以下のパラメーターを決定する:
- 全神経突起伸長
- 最も長い神経突起の長さ
- 支店数
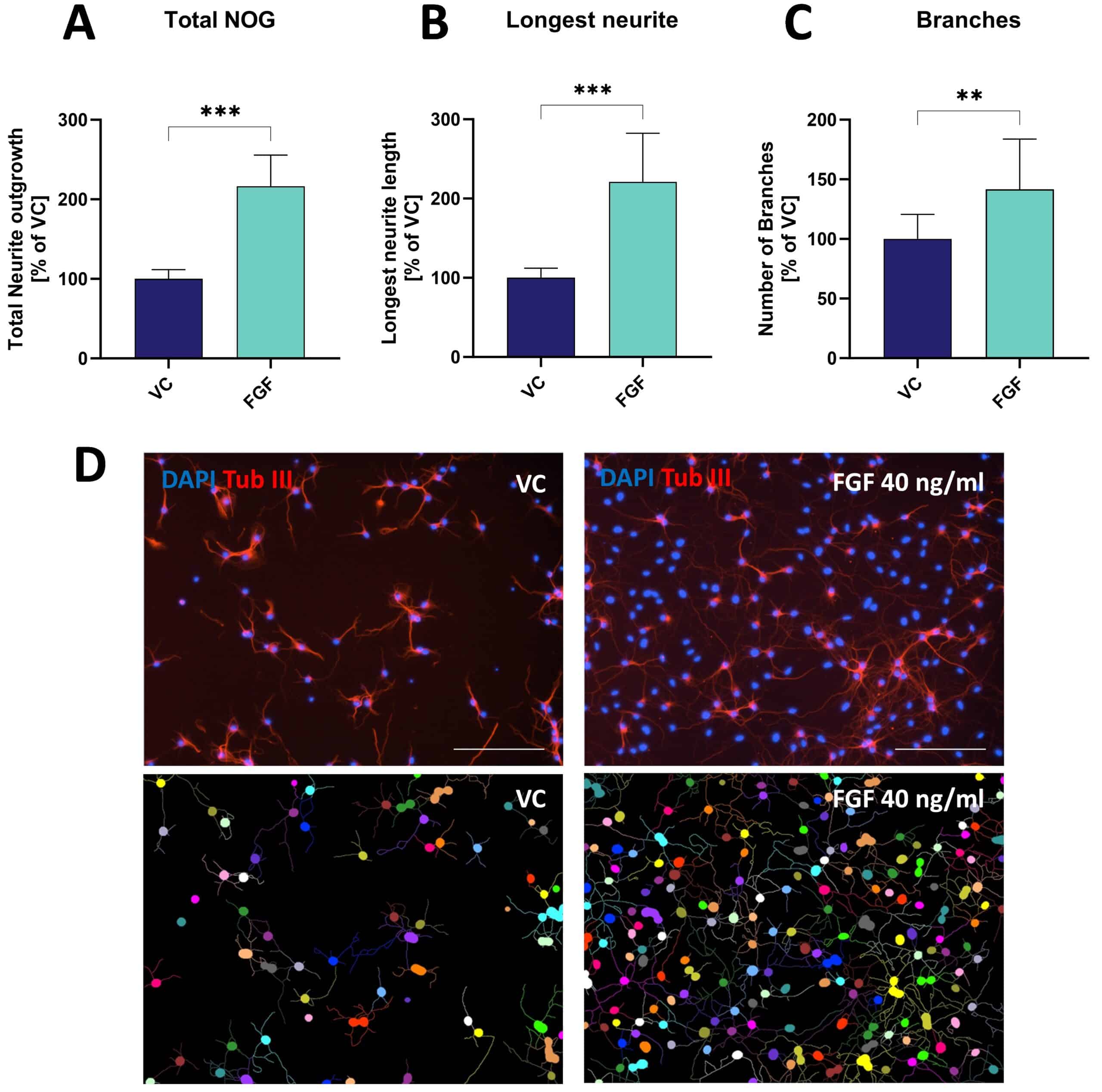
図:マウス初代海馬ニューロンの神経突起伸長(NOG)と分岐に対する線維芽細胞増殖因子(FGF)の効果。
データは、48時間処理後の棒グラフ(A-C)として、群平均+SEMで表示(n=6 / 群)。
非対t検定; **p<0.01; ***p<0.001。
D:NOG解析の代表的画像。
ビヒクル(VC)またはFGFで処理した細胞をβ-チューブリンIIIについて染色した。
解析前(上段)と解析後(下段)の画像。
スケールバー:200μM。
神経突起伸長溶液3
マイクロ流体チャンバー(MFC)は、ソーマから独立した軸索コンパートメントに関するユニークな洞察を提供することができる。そこで我々は、成体野生型マウスの解離した後根神経節(DRG)ニューロンを用いて、MFCにおける軸索損傷と再成長のモデルを提供する。MFCの体節側にニューロンを播種して3日後には、すでに軸索が微小溝を横切り始めている。培養5日後には、軸索は完全に溝を越え、軸索側に美しいネットワークを構築している(図1 A)。その後、軸索コンパートメントから培地を素早く除去することで、神経細胞を軸索切断することができる(図1 B)。
発生化合物は、体細胞と軸細胞の間の静水圧差を利用することで、軸細胞側または体細胞側のどちらか一方だけに選択的に作用させることができる。
ビヒクル処理した細胞と比較して、軸索側へのNGF適用の効果を定量的に分析したところ、交差軸索の数には影響が見られなかったが、分岐と軸索の長さが有意に増加した(Fig.2)。
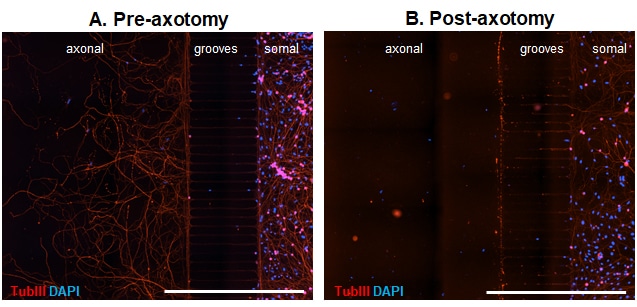
図1. マイクロ流体チャンバー内の野生型成体マウスのDRGニューロンの代表画像。 DRGニューロンをDIV5まで培養し、固定した。 (A)と (B)機械的軸索切断。 Tubulin III (TubIII)標識で神経細胞とその伸長を可視化し、DAPIで核をカウンターステインした。 軸索切断前の軸索側の交差軸索 (A)と軸索切断による軸索の除去 (B). スケールバー1,000μm。
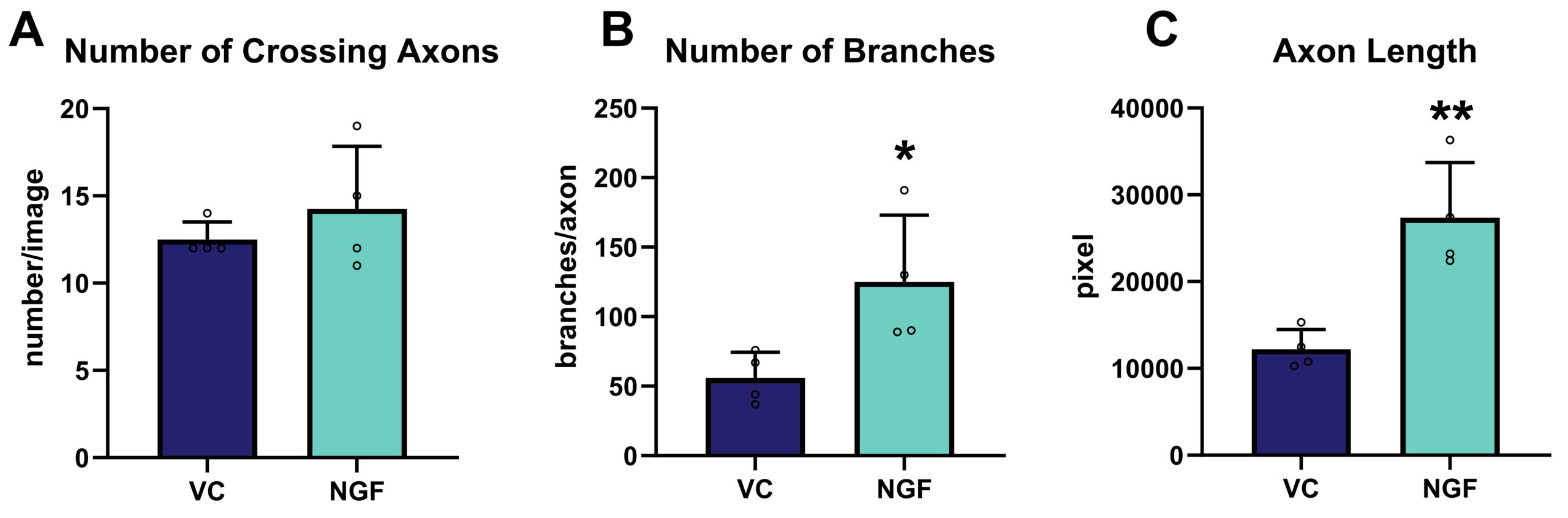
図2. 軸索切断24時間後の軸索再成長に対するNGF処理の効果。 以下のマーカーは、交差軸索の総数を画像ベースで定量化して評価した。 (A)、交差軸索あたりの分岐点数 (B)および全軸索の全長 (C);n=4ウェル/群。 対応のないt検定; *p<0.05;**p<0.01。 VC:ビヒクルコントロール;NGF:神経成長因子。


