B6.SOD1-G93AマウスはシストロンヒトSOD1プロモーターの制御下にG93A変異を持つヒトSOD1を発現しており、SOD1-G93Aマウスと同様であるが、純粋なC57BL/6Jバックグラウンドである。この違いにより、B6.SOD1-G93Aマウスでは病気の進行が遅い。SOD1遺伝子の変異は家族性筋萎縮性側索硬化症(ALSまたはルー・ゲーリッグ病)に関連している。
B6.SOD1-G93Aマウスの最も重要な特徴は以下の通りである:
- 筋肉の緊張
- 筋力低下
- 運動協調運動障害
- 神経炎症
- 神経変性
- オートファジー
- 酸化ストレス
B6.SOD1-G93Aマウスにおける神経炎症の評価では、20週齢のB6.SOD1-G93Aマウスの頚髄において、アストロサイトマーカーGFAP(図1A)とミクログリアマーカーIba1(図1B)の免疫反応面積が有意に増加した。同様の違いが胸髄と腰髄でも観察された(データは示さず)。
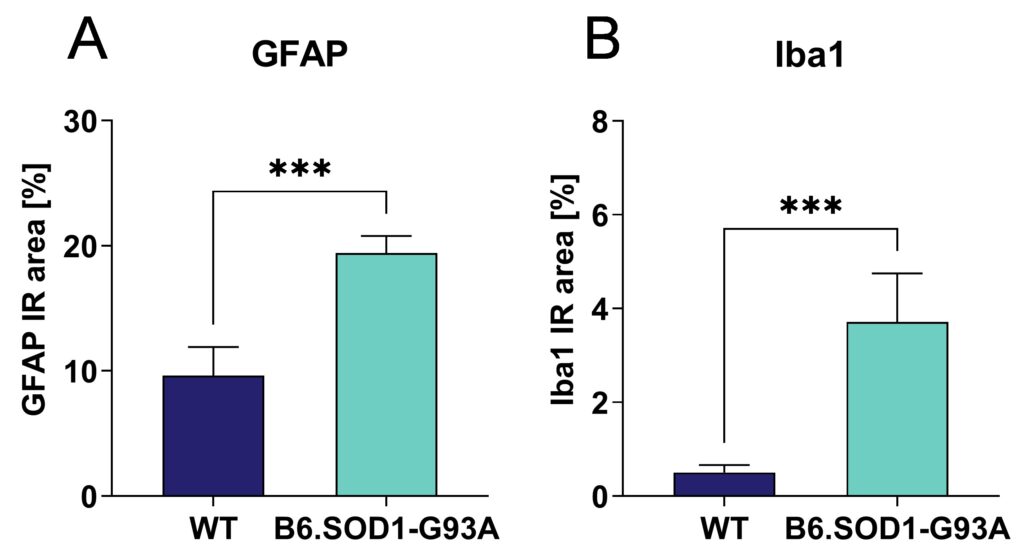
図1:B6.SOD1-G93Aマウスの頚髄における神経炎症。 20週齢のB6.SOD1-G93Aトランスジェニックマウスの頚髄における、アストロサイトーシスとミクログリオーシスをそれぞれ示すGFAP(A)とIba1(B)の免疫反応(IR)面積(%)。平均値+SEM;各群n = 8;t検定;***p<0.001。
B6.SOD1-G93Aマウスにおける神経変性の評価では、14週齢からB6.SOD1-G93Aマウスの血漿中のニューロフィラメント軽鎖レベルが有意に上昇した(図2B)。さらに、腰髄ではコリン作動性ニューロンを標識するChATの免疫反応面積の有意な減少が観察され、神経細胞の消失を示唆した(図2B)。ChAT陽性免疫反応領域の減少は、頚髄ではなく胸髄でも観察された(データは示さず)。
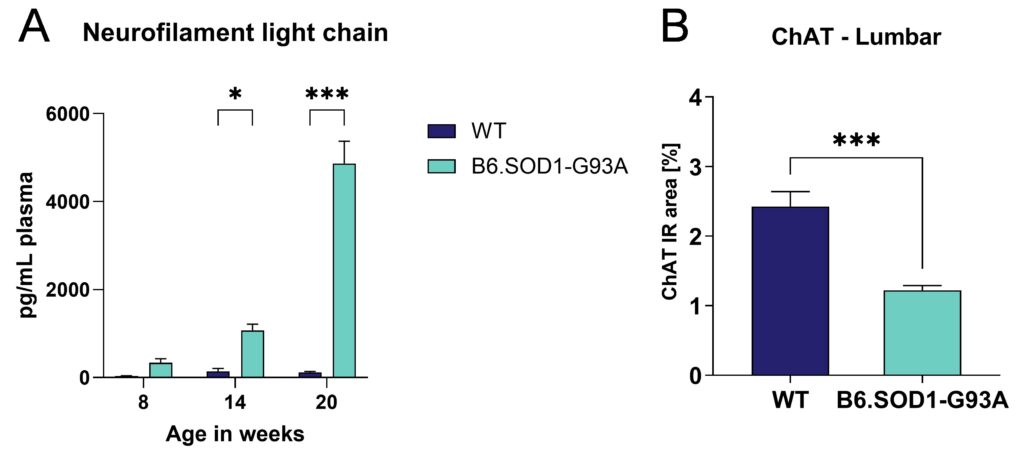
図2:B6.SOD1-G93Aマウスにおける神経変性。 A:B6.SOD1-G93Aトランスジェニックマウスの8、14、20週齢における血漿中の神経フィラメント軽鎖(NF-L)レベル。二元配置分散分析(Two-way ANOVA)とBonferroniのポストホック 検定。B:20週齢のB6.SOD1-G93Aトランスジェニックマウスの腰髄における神経細胞消失を示すChAT免疫反応(IR)面積(%)。T検定。AandB: 平均値+SEM; n = 8/群; *p<0.05; ***p<0.001。
B6.SOD1-G93Aマウスの筋欠損と運動協調性を解析したところ、8週齢で初めて有意差が認められた(図3)。自発的に筋緊張を維持する能力をVercelliスコアリングシステムで測定したところ、B6.SOD1-G93Aマウスでは14週齢で初めて有意差が認められた(図3A)。筋力低下を握力テストで評価したところ、B6.SOD1-G93Aマウスでは8週齢ですでに有意な欠損が認められた(図3B)。筋電図変化の指標として複合筋活動電位(CMAP)を評価したところ、B6.SOD1-G93Aマウスでは非常に早期に欠損が認められた(図3C)。最年少の解析動物は8週齢であったが、握力とCMAPの変化はもっと早く始まる可能性を示す結果であった。
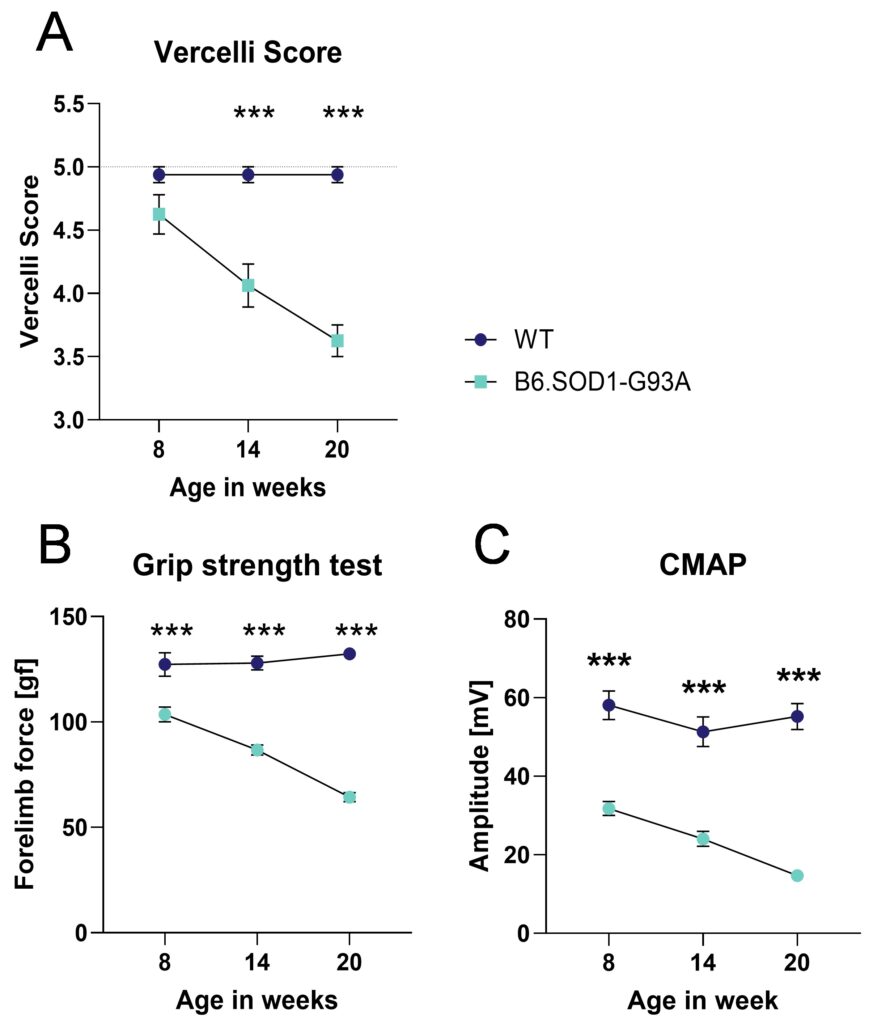
図3:B6.SOD1-G93Aマウスの筋障害と筋電図変化。 8週、14週、20週齢のB6.SOD1-G93Aマウスの筋電図測定時のVercelliスコア(A)、筋力低下を示す握力テスト(B)、複合筋活動電位(CMAP)の振幅(C)を、年齢をマッチさせた野生型(WT)マウスと比較。2元配置ANOVAとBonferroniのポストホック検定;n = 16/群;平均±SEM;***p<0.001。
B6.SOD1-G93Aマウスは典型的なALS症状を示すので、この壊滅的な神経変性疾患の前臨床研究のための貴重なモデルである。B6.SOD1-G93Aマウスの表現型の発症は、古典的なSOD1-G93Aマウスモデルと同等であるが、疾患の進行は遅いようであり、薬理学的介入のための長い治療期間を提供する。
Scantox では、B6.SOD1-G93Aマウスの試験デザインをオーダーメイドで承っており、お客様の特別なご興味に柔軟に対応いたします。また、研究デザインに関するアドバイスやご提案もさせていただきます。B6.SOD1-G93Aマウスは8週齢でALSに関連した表現型を示す。さらに、適切な研究デザインに必要なコントロール動物として、非トランスジェニック同腹仔をご用意しております。
B6.SOD1-G93A マウスモデルを用いて、貴社の化合物の有効性を評価させていただきます!
最も一般的な表示は以下の通り:
以下の関連トピックにもご興味があるかもしれません:
お問い合わせをお待ちしております。
