2006年、Neumannらにより、ヒト筋萎縮性側索硬化症(ALS)の脳サンプルにおいて、RNA結合タンパク質TDP-43の凝集体と局在異常が発見された。
それ以来、in vitro およびinvivoでの TDP-43の過剰発現がALSの病態を引き起こすことが示され、ALSの根本的なメカニズムを研究するのに適したモデルとなった。
しかし、トランスジェニックALSモデルマウスでは、病態は急速に進行し、致死的である。
そこで我々は、ヒトTDP-43(hTDP-43)を発現する血清型9型アデノ随伴ウイルス(AAV9)を成体C57Bl6マウスの運動皮質に注射することにより、進行が緩やかな誘導性ALSモデルマウスを樹立した。
hTDP-43 mRNAおよびタンパク質の恒常的発現は、RT-qPCR法および組織学的手法で評価したところ、注入後3、6、9ヶ月で確認された(図1A、B)。
より詳細には、四重免疫蛍光標識により、大脳皮質のCTIP2陽性ニューロンを含むほぼ神経細胞のみが形質導入され、GFAP陽性アストロサイトはTDP-43陰性であることが明らかになった(図1C)。 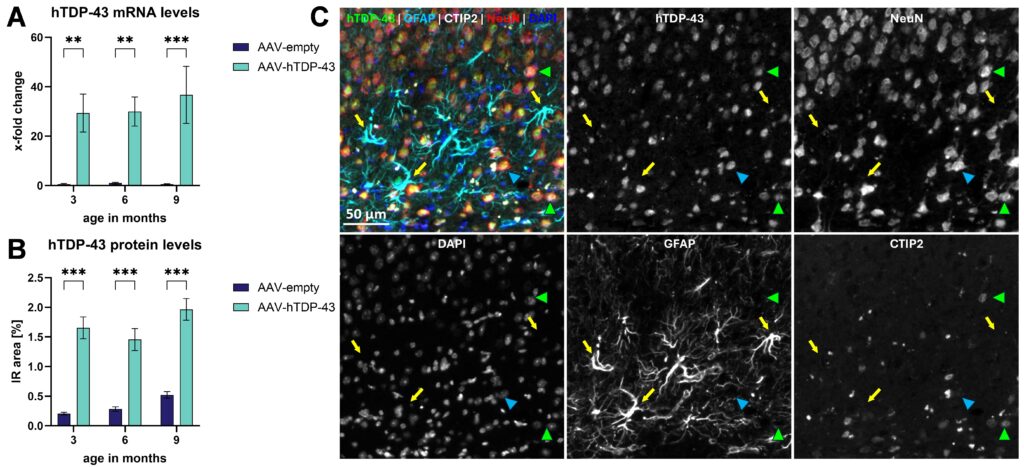
図1:AAV-hTDP-43注射マウスにおけるhTDP-43 mRNAとタンパク質の発現プロファイル。 hTDP-43 mRNAのレベル
(A)とタンパク質
(AAV-hTDP-43対AAV-emptyコントロール注射後の運動皮質における(B)。
AAV-hTDP-43を注射した動物の運動皮質におけるhTDP-43(緑)、GFAP(青緑)、CTIP2(白)、NeuN(赤)、DAPI(青)の代表的な5チャンネル画像と、同じマーカー(白)の1チャンネル画像。
hTDP-43シグナルは、CTIP2陽性細胞(緑の矢印の頭)を含むNeuNと共局在するが、GFAP陽性アストロサイト(黄色の矢印)とは共局在せず、hTDP-43の純粋な神経細胞発現を示している(矢印の頭)。
二元配置分散分析(Two-way ANOVA)とボンフェローニのポストホック検定。
平均値±SEM。
**p<0.01; ***p<0.001。
各群n = 8。
AAV-hTDP-43の注入はさらに、定量的免疫蛍光画像解析を用いて、注入後3ヶ月、6ヶ月、9ヶ月のGFAPシグナルの強い増加をもたらした(図2A)。
GFAPシグナルの詳細な評価では、GFAP陽性細胞の数が増加し、これらの細胞は対照群の細胞と比較して細胞あたりより大きく、より多くのGFAPを発現していた(データは示さず、詳細はお問い合わせください)。
これらの結果は、アストロサイトの総数が増加し、TDP-43の発現によりそのようなアストロサイトが活性化され、注射後9ヶ月経過しても安定していることを示している。
さらに、運動皮質の面積は、AAV-hTDP-43を注射した動物では、注射後6ヶ月および9ヶ月の対照動物と比較して有意に小さかった;この効果の傾向は、AAV-hTDP-43の適用後3ヶ月ですでに見られた(図2B)。 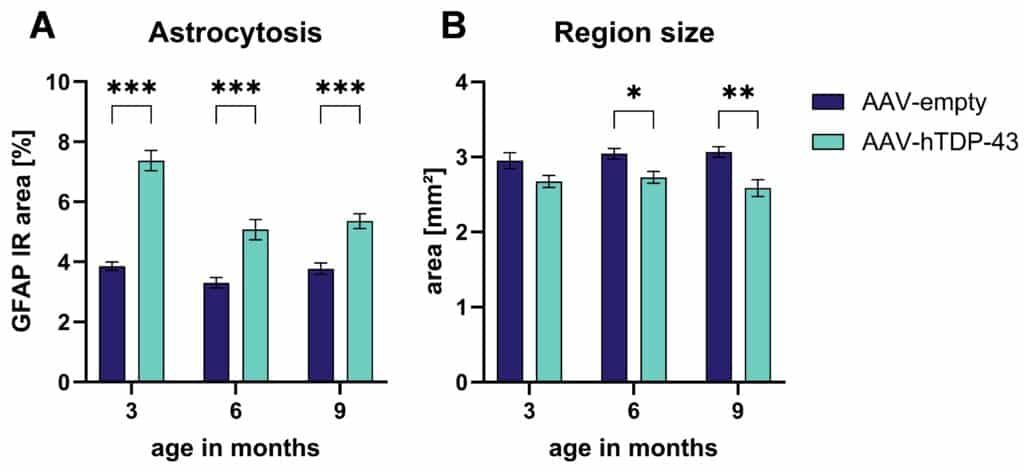
図2:AAV-hTDP-43注射マウスにおける運動野のアストログリオーシスと萎縮。 GFAP免疫反応(IR)領域の定量化
(A)と領域サイズ
(AAV-hTDP-43とAAV-emptyコントロールの注入3、6、9ヵ月後の運動皮質領域(B)。
二元配置分散分析(Two-way ANOVA)とボンフェローニのポストホック検定。
平均値±SEM。
*p<0.05; **p<0.01; ***p<0.001。
各群n = 8。
結論として、我々は、成体C57Bl6マウスの運動皮質にAAV-hTDP-43を注射することにより、新たな誘導性hTDP-43モデルを確立した。
ウイルスを注入した結果、神経細胞のみにhTDP-43が導入され、アストログリオーシスによって観察される神経炎症と運動皮質の萎縮が観察された。
その結果、このモデルは基礎研究だけでなく、薬剤開発研究にも使用することができる。AAV-hTDP-43注入マウスを用いたALS研究をご希望の方は、今すぐ弊社までご連絡ください。









