2つの異なる濃度のロテノンを野生型マウスの右線条体に直接注射すると、同じ動物の同側およびDMSOを注射した同腹子の対側と比較して、梁歩行試験における対側の滑りが有意に増加した(図1A)。
この表現型は、高用量ロテノンによる病変後少なくとも4週間は測定可能である(図1B)。 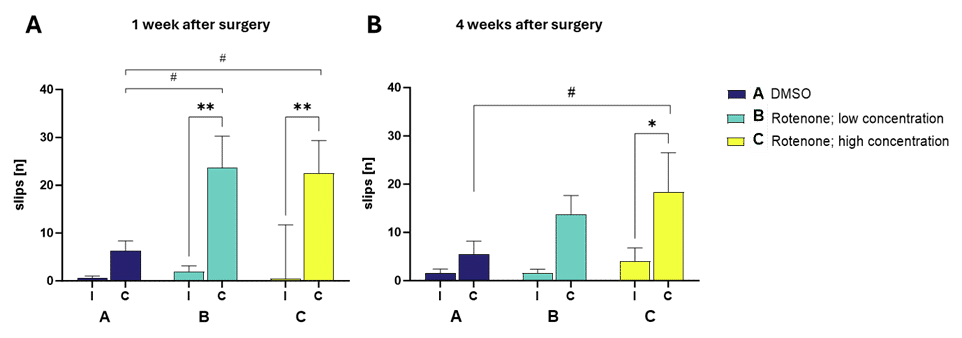
図1:10mm角の梁を横切る際の梁歩行試験における同側(I)と対側(C)のスリップ回数 1
(A)および4
(B)週後。 平均値+SEM。
n=3-6.
二元配置分散分析(Two-way ANOVA)後、Bonferroniのpost hoc 検定;*対側コントロール注射と比較;#DMSO注射と比較。
**p> 0.01、*p> 0.05。
さらに、片側ロテノン注射脳の組織学的評価では、投与4週間後に黒質(SN)の神経変性が観察され、ドーパミン作動性ニューロンのチロシン水酸化酵素(TH)シグナルが減少していた(図2)。
加えて、グリア線維性酸性タンパク質(GFAP)とイオン化カルシウム結合アダプター分子1(Iba-1)のレベルが上昇しており、それぞれアストロ・グリオーシスとミクログリオーシスを示唆している(図2)。 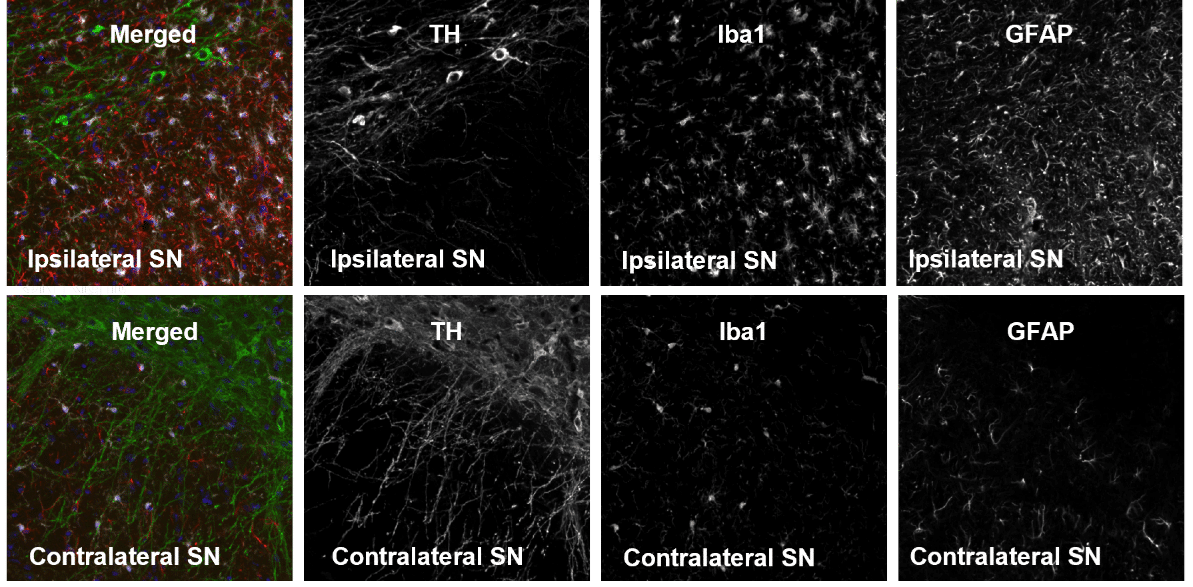
図2:高用量ロテノン注射28日後の同側および対側の黒質(SN)におけるTH、Iba1およびGFAP標識の代表的画像。 ロテノンはミトコンドリア複合体Iを阻害する天然農薬であり、炎症を誘発し、黒質ドパミン作動性細胞を選択的に破壊することがすでに示されている。
この脳内ロテノンモデルで観察された運動障害、ドパミン作動性ニューロンの選択的喪失、黒質経路における神経炎症は、ヒトのパーキンソン病の表現型を忠実に再現しており、このモデルはこの壊滅的な疾患の病理学的メカニズムを研究するための貴重なツールとなっている。ロテノンを注射したマウスを用いたin vivo研究をご希望の方は、今すぐお問い合わせください。
その他のin vitroおよびin vivoトランスジェニックおよび誘導パーキンソン病モデルもご覧ください。