AAV2 hA53T-α-syn誘導マウスモデル
AAV2 hA53T-α-syn(A53T変異を有するヒトα-シヌクレイン)の黒質への単回片側注射を受けた野生型C57BL/6マウスは、同側半球でhA53T-α-synを選択的に発現する。
AAV2 hA53T-α-syn誘導マウスの最も重要な特徴は以下の通りである:
- 異なる脳領域におけるヒトA53T-αシヌクレインの発現
- ミクログリオーシス
- チロシン水酸化酵素レベルの低下
AAV2 hA53T-α-synを注射した脳の組織学的解析では、注射した脳半球の尾状核だけでなく、黒質でもhA53T-α-synタンパク質レベルの増加が見られた。
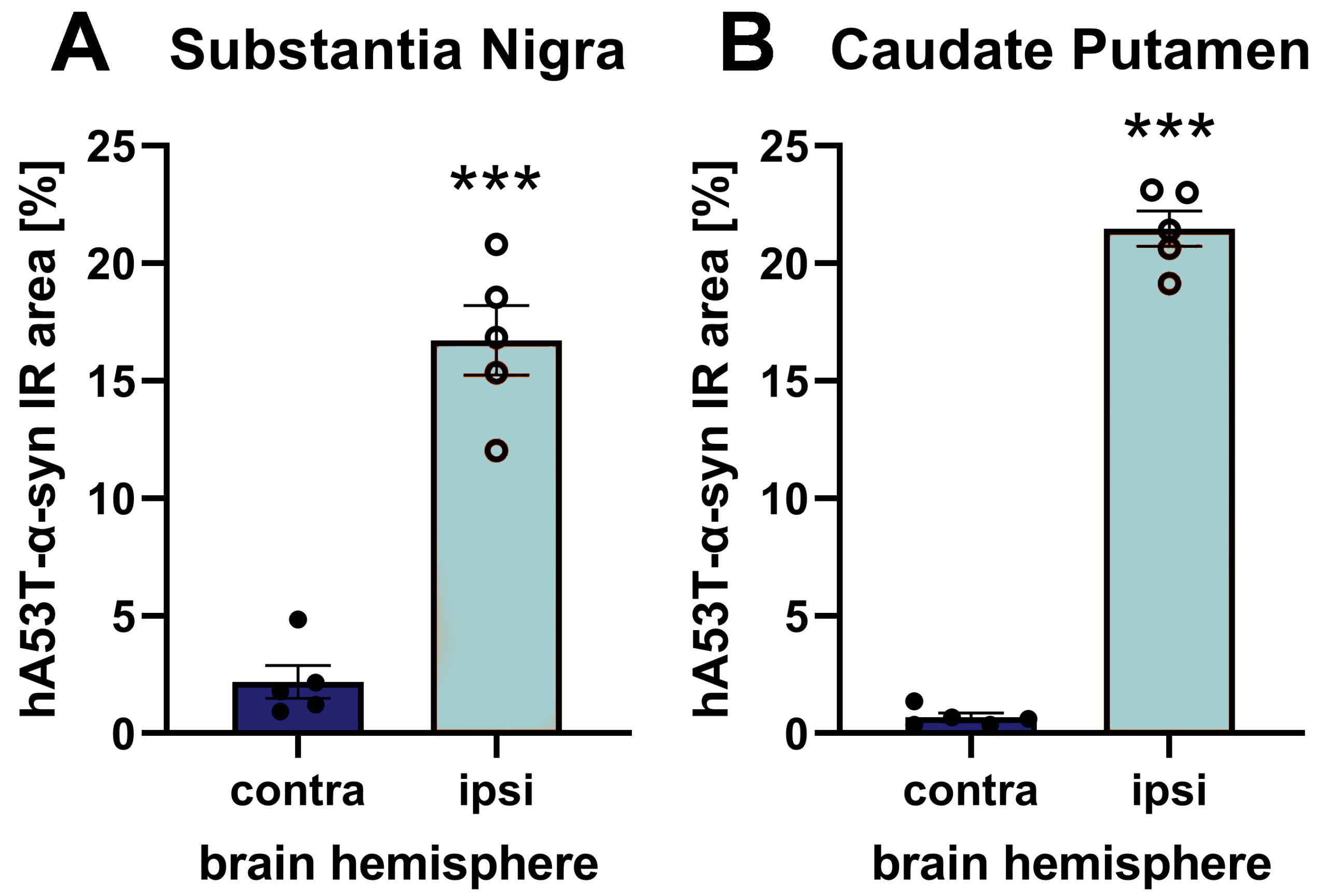
図1:黒質におけるhA53T-α-syn免疫反応領域(IR) (A)と尾状被蓋におけるhA53T-α-syn免疫反応領域(IR) (同側半球の黒質に片側AAV2 hA53T-α-synを注入した後の、反対側半球と同側半球の尾状被蓋におけるhA53T-α-syn免疫反応領域(IR)。 注射9週後に安楽死させ、ヒト特異的α-syn抗体を用いて脳を評価した。 n = 5 /群; 対にしないt検定; 平均±SEM。 ***p<0.001。
hA53T-α-synの発現はさらに、神経炎症のマーカーである活性化ミクログリアの増加をもたらし、免疫蛍光標識の定量化によって評価すると、注射した黒質におけるチロシン水酸化酵素(TH)レベルも強く低下した。

図2:Iba1 (A)とTH (B)同側半球黒質への片側AAV2 hA53T-α-syn注入後の対側および同側半球黒質における免疫反応領域(IR)。 注射9週後に安楽死させた。 n = 5 /群; 対にしないt検定; 平均±SEM。 *p<0.05; **p<0.01。
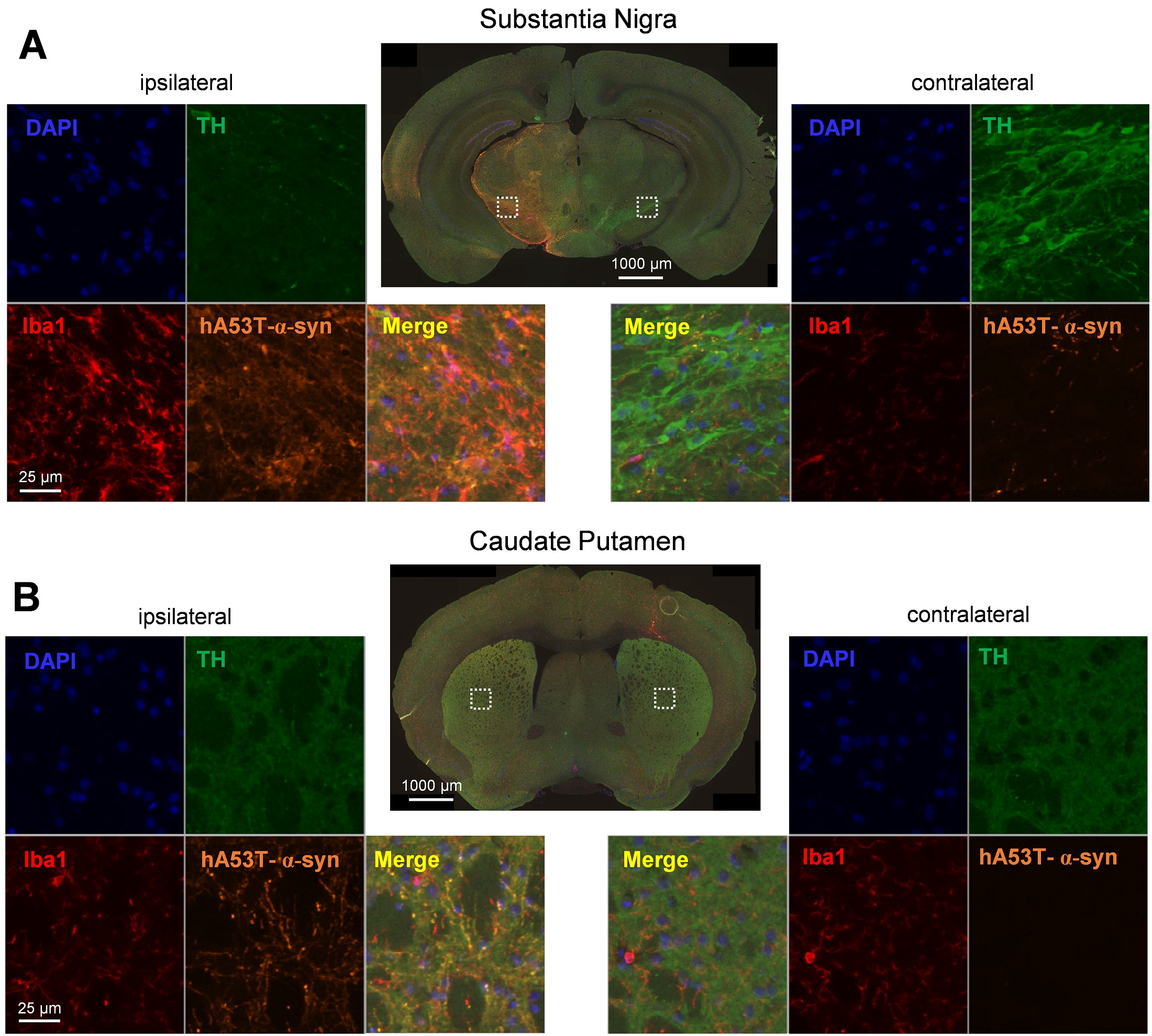
図3:黒質の同側半球(左)と対側半球(右)におけるhA53T-α-syn、チロシン水酸化酵素(TH)、Iba1、DAPIの代表的な標識像 (A)および尾状核 (同側半球の黒質に片側AAV2 hA53T-α-synを注入した後(B)。
MPTP誘発マウスモデル
ピリジン毒素1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン(MPTP)の急性、慢性、亜慢性投与を受けたマウスは、中脳の2つの構造、黒質(SN)と腹側被蓋野(VTA)において、選択的にドーパミン作動性ニューロンを著しく失う。 SNにおけるドーパミン細胞の消失は、パーキンソン病の臨床状態を模倣し、運動機能障害を引き起こす。
マウスのVTAにおけるドーパミン作動性の低下は、パーキンソン病との関連は不明であるが、これらのニューロンが前頭皮質に投射しているため、パーキンソン病の認知障害に寄与している可能性がある。
MPTP病変マウスの最も重要な特徴は以下の通りである:
- 活動量の減少
- 黒質とVTAにおけるドーパミン作動性ニューロンの消失
- 尾状被蓋におけるDOPACとHVAの減少
- 黒質におけるTHの減少
投与2日後のMPTP投与マウスの行動解析では、偽麻酔マウスと比較して活動性が有意に低下した(図1)
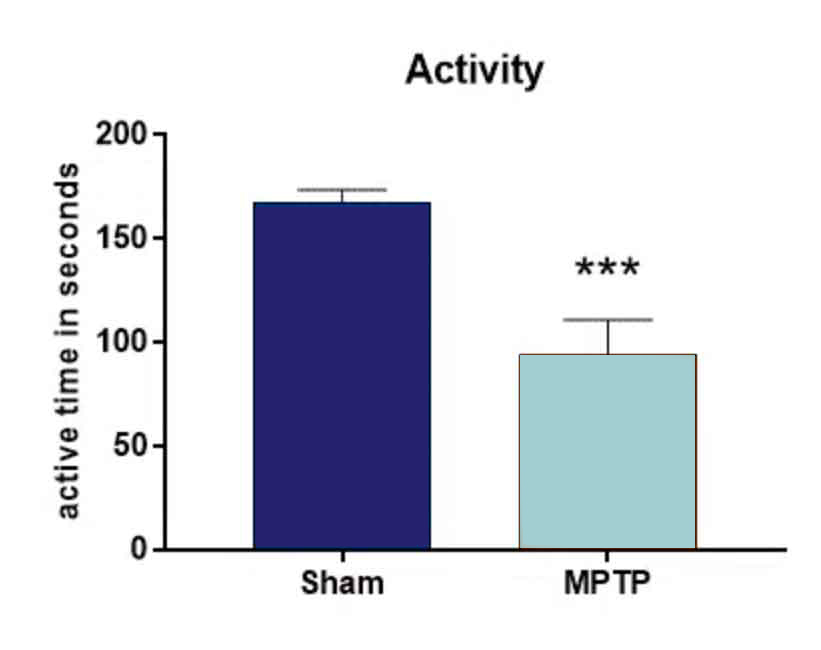
図1:オープンフィールドテスト。 動物には1日に4 x 20 mg/kg MPTPまたはビヒクルを注射した。 投与2日後、動物はオープンフィールドテストで活動性をテストされた。 n = 9-10/群; 対にしないt-検定; 平均+SEM。 ***p<0.001。
MPTP-leion後の黒質におけるチロシン水酸化酵素(TH)を定量すると、偽leion対照マウスと比較してTHレベルが有意に低下した(図2)。
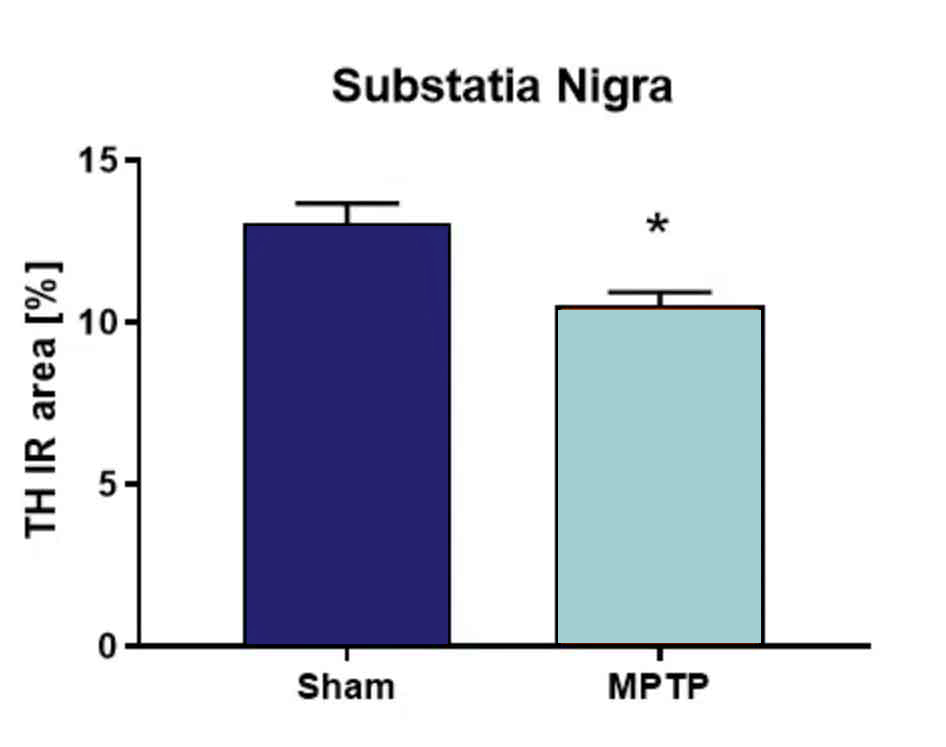
図2. MPTP病変後の黒質におけるチロシン水酸化酵素(TH)の定量。 動物に4×20mg/kgのMPTPまたはビヒクルを1日1回注射した。 投与6日後に動物を犠牲にし、THレベルについて黒質を分析した。 n=3-5/群; 対にしないt-検定; 平均+SEM。 *p<0.05。
したがって、MPTP処理マウスは、運動障害やドーパミン作動性ニューロンの喪失、またこれらのパラメータに対する薬物の影響の可能性を研究するのに適したモデルである。
6-OHDA誘発マウスモデル
6-OHDAをネズミの脳の特定部位に片側から注射すると、酸化ストレスによってカテコールアミン作動性ニューロンに障害が引き起こされる。 投与量や注射部位にもよるが、この結果、チロシン水酸化酵素(TH)免疫反応性の消失によってしばしば示されるように、ドーパミン作動性ニューロンの深刻な喪失が起こる。 この病態は、PDの主要な特徴の一つである、中胸系におけるドパミン欠乏を模倣している。 そのため、6-OHDA病変は35年以上にわたってPDのモデルとして用いられてきた。
6-OHDAの一般的な注射部位は、内側前脳束、線条体のさまざまな部位(単一または複数の注射部位)、または黒質である。
MFBに注射された6-OHDA病変ラットの最も重要な特徴は以下の通りである:
- 円柱と回転テストにおける側方行動障害
- 尾状被蓋におけるチロシン水酸化酵素レベルの低下
- 尾状被蓋におけるDATレベルの低下
- 尾状被蓋におけるアストロサイトーシスと活性化ミクログリア
内側前脳束(MFB)の片側6-OHDA病変は、シリンダーテストと回転テストによって分析すると、病変を加えてから3週間後に強い外側行動障害をもたらす(図1)。
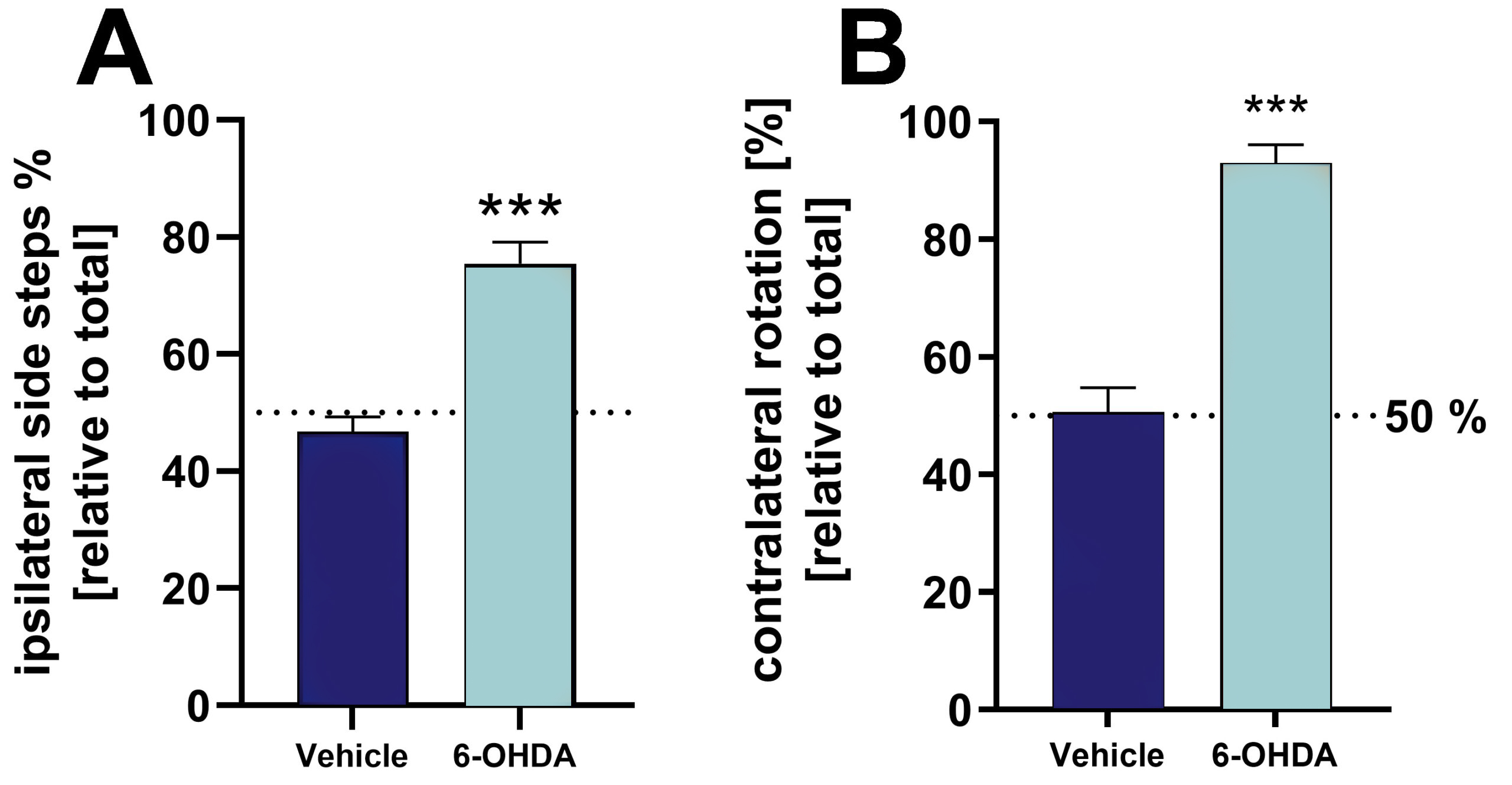
図1:6-OHDA注射ラットとビヒクル注射ラットのシリンダーテストと回転テストによる6-OHDA病変の検証。 A: シリンダーテストにおける全サイドステップに対する同側サイドステップ[%]。 B: 回転テストにおける相対的対側回転。 テストは6-OHDA病変の3週間後に行った。 回転テストではアポモルヒネを投与して回転行動を誘導した。 平均値+SEM。 対応のないt-検定。 n = 8(ビヒクル)と19(6-OHDA); ***p<0.001。
L-DOPA/ベンセラジドを3つの濃度で投与すると、シリンダーテストで観察された側行動効果を逆転させることができる(図2A)。 回転試験における6-OHDAラットのさらなる評価によると、対側回転の相対回数は、異なるL-DOPA濃度によって影響を受けないことが示された(図2B)。
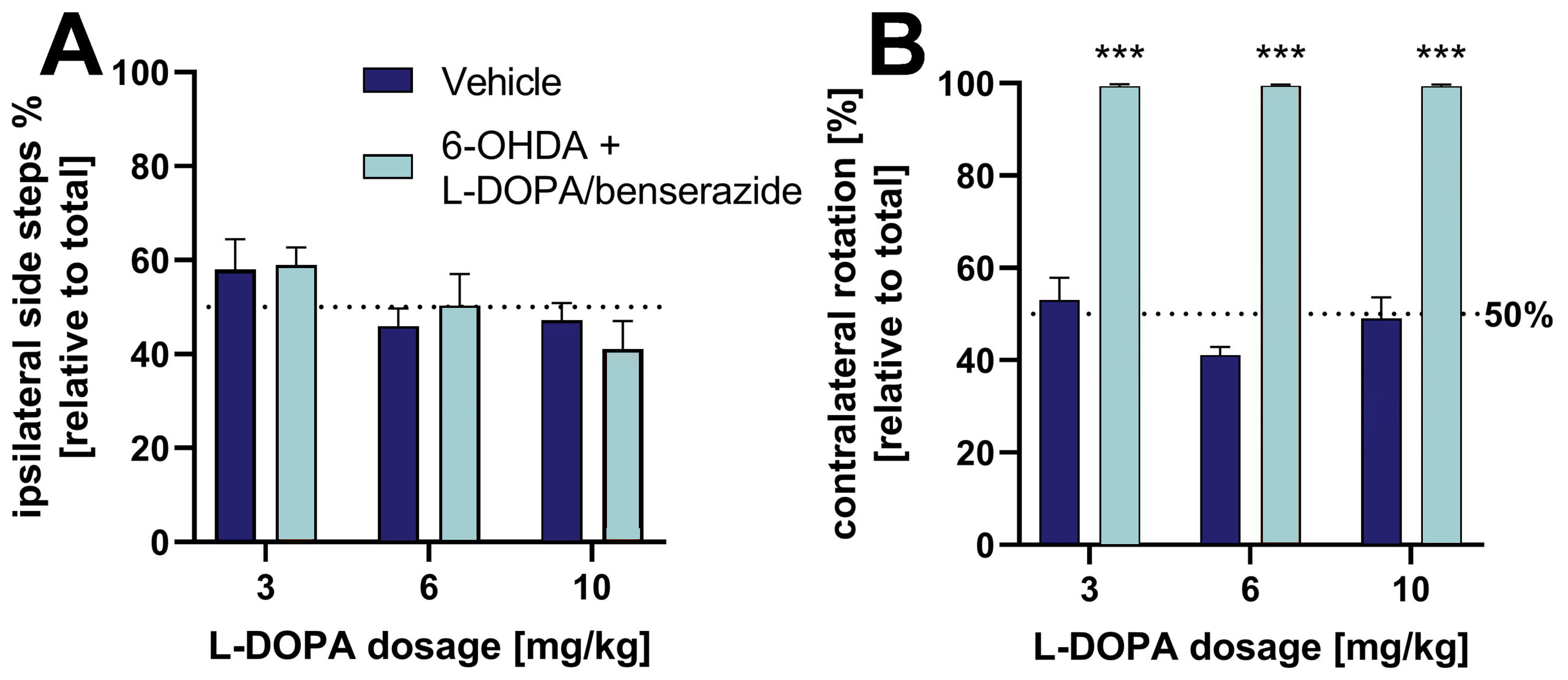
図2:L-DOPA/ベンセラジドが6-OHDA病変ラットのシリンダーテストおよび回転テストにおける側方行動に及ぼす影響。 A: シリンダーテストにおける全サイドステップに対する同側サイドステップ[%]。 B: 回転テストにおける相対的対側回転。 回転テストでは動物をアポモルヒネで処理し、回転行動を誘導した。 平均値+SEM。 二元配置分散分析(Tukey’sおよびSidak’sポストホック検定)。 n = 8(全ビヒクル群)および16(全6-OHDA群); ***p<0.001。
MFBの6-OHDA病変から5週間後の尾状被蓋におけるチロシン水酸化酵素(TH)およびDAT陽性免疫反応領域(IR)を組織学的に評価したところ、病変側の脳でTHおよびDATレベルが強く低下していた(図3A、B)。 MFBの6-OHDA病変後、尾状被蓋におけるグリア線維酸性タンパク質(GFAP)およびIba-1陽性免疫反応領域を組織学的に評価したところ、病変側脳の尾状被蓋においてGFAPおよびIba-1レベルの増加が認められた(図3C、D)。 これらのデータは、アストロサイトーシスと活性化ミクログリアによって示されるように、6-ODHA病変が神経炎症を誘発することを示している。
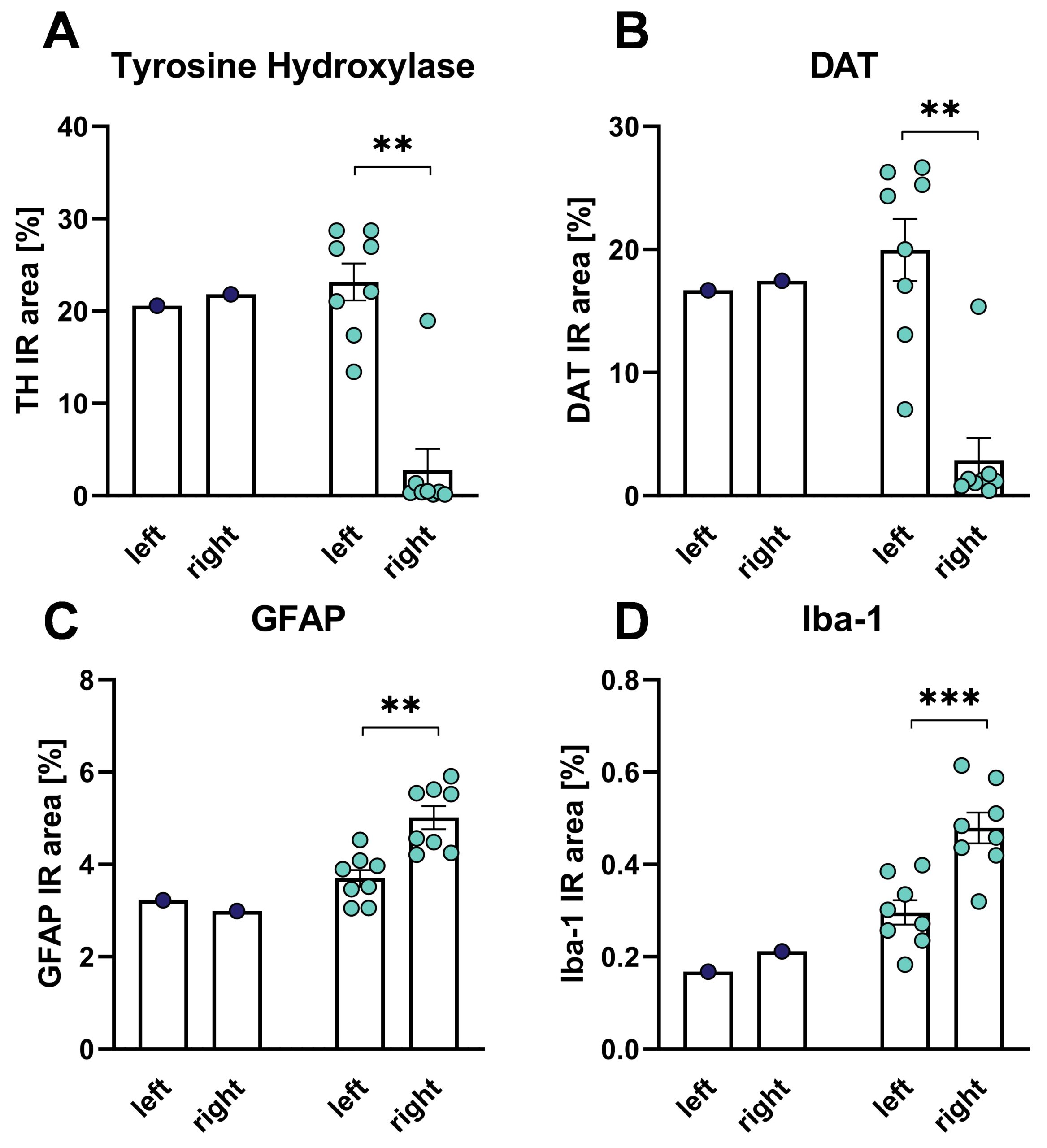
図3:尾状被蓋におけるチロシン水酸化酵素(TH、 A)、DAT (B)、GFAP (C)およびIba-1 (D)ラットのMFBの6-OHDA病変後のIR領域。 6-OHDA群のみでの対応のないt-検定。 6-OHDA:n=8;ビヒクル:n=1。 平均値+SEM。 **p<0.01、***p<0.001。 左:無処置側、右:処置側。 青:ビヒクル群、オレンジ:6-OHDA群。
ハロペリドール誘発カタレプシー
カタレプシーは、パーキンソン病、てんかん、緊張病、また統合失調症治療薬など処方された薬剤の副反応として見られる神経症状である。 カタレプシーは、身体の硬直を伴う感覚や意識の喪失を伴う発作を特徴とする。 ドーパミンD2受容体拮抗薬ハロペリドールをラットに投与すると、典型的な症状を模倣してカタレプシーを急性的に数時間誘発することができる。
Sprague Dawleyラットに1mg/kgのハロペリドールを皮下注射する。 30分後、カタレプシーを測定し、さらにカタレプシーの全スペクトルを示す動物に陽性化合物またはビヒクルを経口投与する。 薬物投与後、いくつかの時点で動物のカタレプシーを再検査することができる。
ハロペリドール投与ラットの最も重要な特徴は以下の通りである:
- 意識喪失
- ボディ剛性
カタレプシーは、ラットの前肢を高さ8cmの水平なバーの上にそっと置くことで評価できる。カタレプシーは、動物が動かずにいる時間として測定できる。 120秒をカットオフタイムとする。
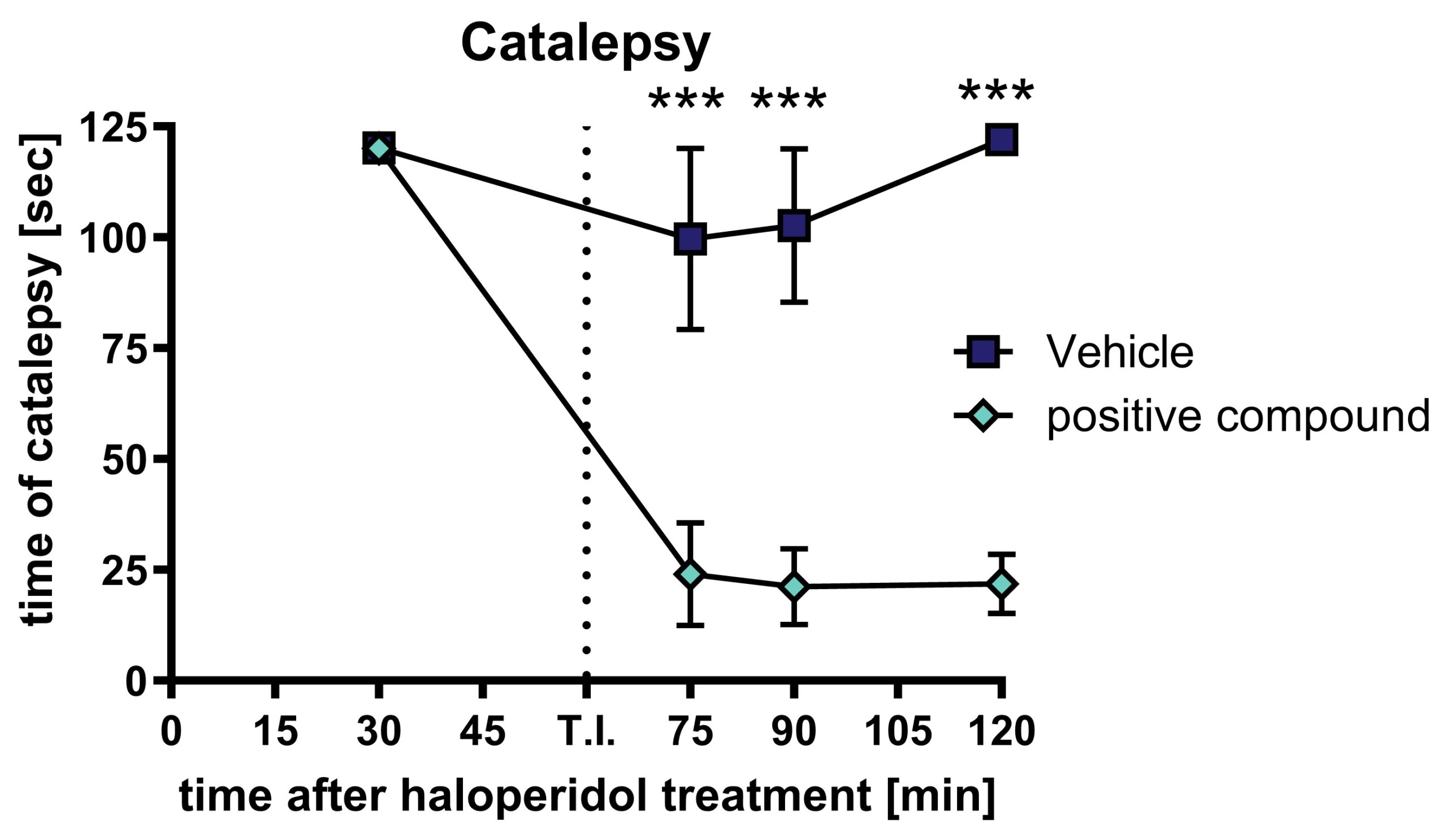
図1:陽性化合物投与後のハロペリドール誘発カタレプシー:1mg/kgのハロペリドールを皮下投与した後、陽性化合物を経口投与し、動物が硬直した時間。 動物はカタレプシーについて繰り返しテストされた。 n = 10. 平均値±SEM。 二元配置分散分析(Bonferroniの反復測定ポストホック検定付き)。 ***p<0.001。 T.I.:試験項目/陽性化合物。
Scantoxでは、すべての誘導PDモデルに対してカスタムメイドの試験デザインを提供しており、お客様の特殊な関心にも柔軟に対応いたします。 また、研究デザインに関するアドバイスやご提案もさせていただきます。 すべての誘導モデルは、治療後すぐにパーキンソン病(PD)に関連する表現型を示します。 このため、PD研究の迅速な実施が可能です。 さらに、ビヒクルを注射した野生型マウスや、注射した動物の対側半球は、適切な試験デザインに必要なコントロールとして機能します。
弊社では、PD誘発動物モデルにおける貴社の化合物の有効性を評価させていただきます! 最も一般的な測定値はモデルによって異なり、以下のようなものがあります:
