タウオパチー患者から精製したタウ凝集体をマウスの脳に注入すると、患者のタウオパチーの主な病理学的特徴を再現することができる。
このアプローチにより、タウオパチーに特異的な病態を解析することが可能となり、高いトランスレーショナルバリューを持つ。
注入には、ヒトタウを発現するが内因性タウを欠く9-10週齢のhTauマウスを用いた。
マウスは、AD BraakステージVI患者のサルコシル不溶性タウの種子を海馬とその上の頭頂皮質に片側注射された。
注射から12週間後に動物を犠牲にし、セリン202/スレオニン205(pSer202/pThr205)のリン酸化タウの病理学的変化について脳を分析した。
リン酸化タウは同側の大脳皮質と海馬だけでなく、対側半球でも測定可能であり、タウの播種と対側へのタウの拡散を示した(図1)。 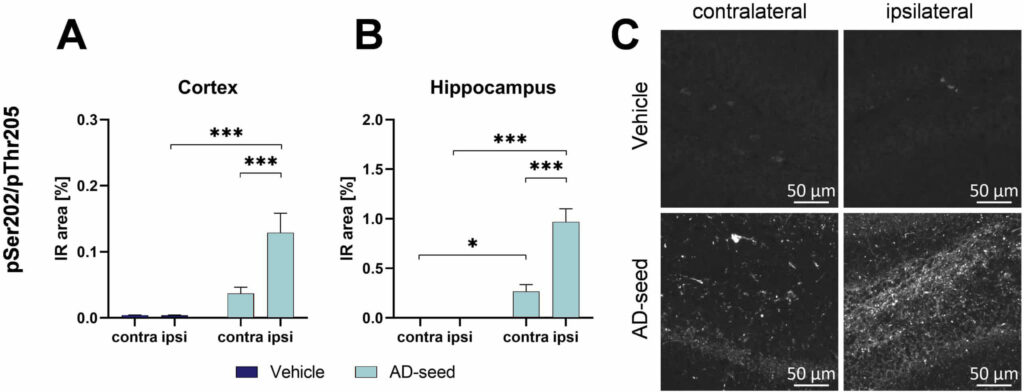 図1:同側半球の海馬とその上の皮質に片側AD脳シードを注入した後、反対側半球と同側半球の頭頂皮質(A)と海馬(B、C)におけるpSer202/pThr205タウ免疫反応性。
図1:同側半球の海馬とその上の皮質に片側AD脳シードを注入した後、反対側半球と同側半球の頭頂皮質(A)と海馬(B、C)におけるpSer202/pThr205タウ免疫反応性。
注入12週後に安楽死させ、AT8抗体を用いて脳を評価した。
IR = 免疫反応領域。
n = 8 /群; 2-way ANOVAとŠídák´spost hoc検定による多重比較; 平均+SEM。
*p<0.05; ***p<0.001。
ニューロン、アストロサイトーシス、細胞核を標識するマーカーを用いた脳組織切片の免疫組織学的解析により、注射した同側半球の歯状回顆粒細胞層の構造変化が明らかになった(図2)。 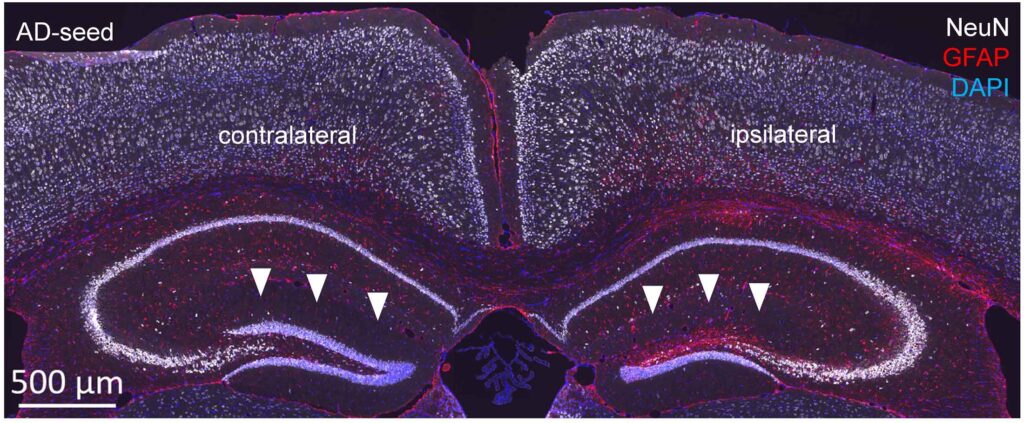 図2:神経細胞体節のマーカーであるNeuN、アストロサイトーシスのマーカーであるグリア線維酸性タンパク質(GFAP)の免疫蛍光標識と、細胞核を可視化するためのDAPI染色。
図2:神経細胞体節のマーカーであるNeuN、アストロサイトーシスのマーカーであるグリア線維酸性タンパク質(GFAP)の免疫蛍光標識と、細胞核を可視化するためのDAPI染色。
タウシードを注入した同側と対照側の歯状回顆粒細胞層の構造変化に注目(白矢印頭)。
この結果は、AD患者由来のタウ凝集体の播種が、構造的・生理学的レベルでタウオパチーを忠実に模倣していることを示唆しており、したがってこのモデルがタウオパチーを研究するための貴重なツールとなっている。タウ播種研究の開始については、今すぐお問い合わせください!
科学ニュース
脳内ロテノン投与によるパーキンソン病発症機序の解明
May 26, 2025
細胞からマウスへ:ゴーシェ病研究のための患者由来モデルと前臨床モデル
April 23, 2025
すべては加齢のせい
March 26, 2025
ブログ

初期アルツハイマー病発症の窓としての血漿GFAP:5xFADマウスモデルからの機序的洞察
July 9, 2025

ニーマン・ピックC型における治療法の拡大:新規BMPヒドロラーゼ標的としてのPLA2G15
July 2, 2025

脳細胞プラットフォームが画期的なアルツハイマー治療薬ALT001につながる
June 24, 2025

神経経路オルガノイドが痛みのシグナルに迫る
June 17, 2025
会社ニュース

Scantox AAALACの完全認定を取得-動物福祉と科学的誠実さへの取り組みを強化
June 27, 2025

アニュアルレポート2024を発表
April 28, 2025

ACT 2024:Scantox 「拡大するトキシコロジー・サービス」で一歩先を行く
November 4, 2024

Scantox、ESGCT 2024で細胞・遺伝子治療能力を披露
September 29, 2024

