ニーマン・ピック1型マウスモデルであるNPC1-/-マウスの強い病態は、シクロデキストリン処理によって有意に軽減される。
ここでは、シクロデキストリン(2-ヒドロキシプロピル-β-シクロデキストリン、HPBCD)がコレステロール値だけでなく肝酵素値も改善することを示す。
NPC1-/-マウスに週1回、3週間皮下投与すると、血漿中のトリグリセリド値は増加するが(図1C)、肝コレステロール値は減少する(図1A)。
NPC1-/-マウスでは血漿コレステロール、HDLおよびLDLレベルが上昇するが、シクロデキストリン処理によってこれらの病態が有意に逆転することはない(図1B、D、E)。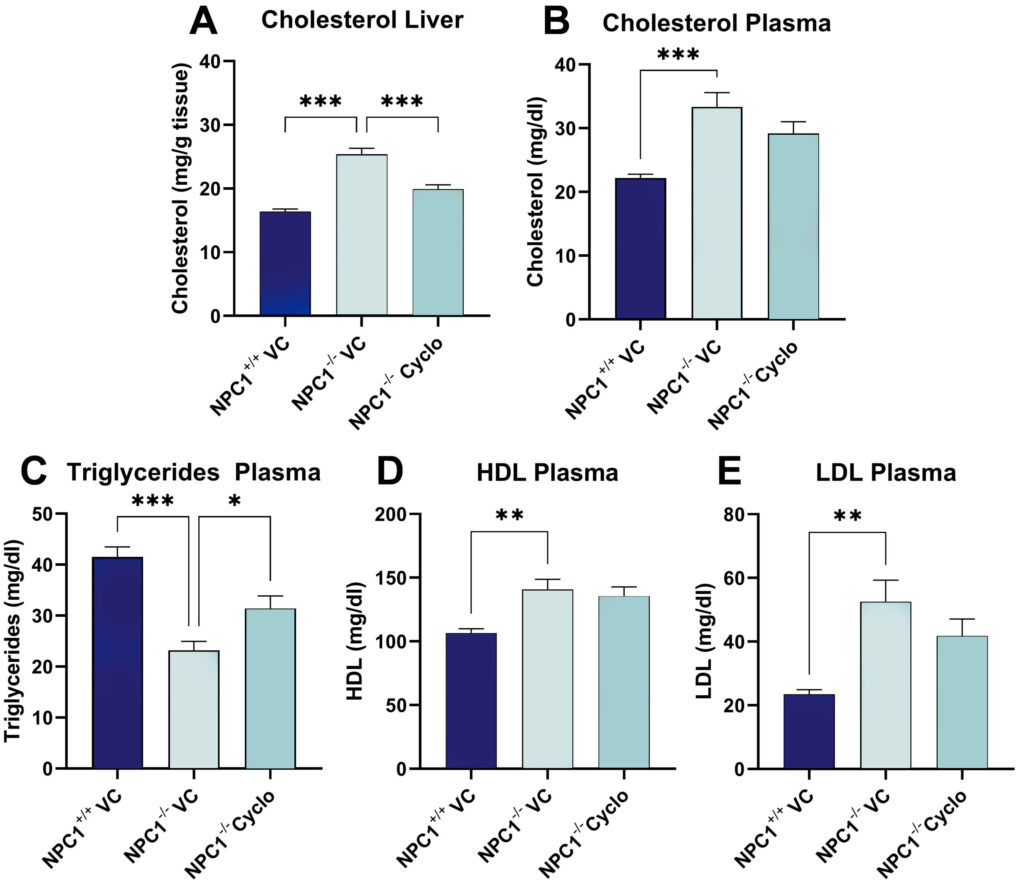 図1:コレステロール、トリグリセリド、HDLおよびLDLに対するシクロデキストリン処理の影響。 NPC 1-/-および野生型動物(各群n = 6)を用いて肝臓中のコレステロールを分析した。
図1:コレステロール、トリグリセリド、HDLおよびLDLに対するシクロデキストリン処理の影響。 NPC 1-/-および野生型動物(各群n = 6)を用いて肝臓中のコレステロールを分析した。
(A)、コレステロール
(B)、トリグリセリド
(C)、HDL
(D)およびLDL
(シクロデキストリン(サイクロ)またはビヒクルで3週間処理した後、血漿中のコレステロール(A)、コレステロール(B)、トリグリセリド(C)、HDL(D)およびLDL(E)を分析した。
一元配置分散分析(One-way ANOVA)後、ダンの多重比較ポストホック試験;平均+SEM; *p<0.05; **p<0.01; ***p<0.001。
肝酵素を評価したところ、NPC1-/-マウスではアスパラギン酸アミノトランスフェラーゼ(AST)、アラニンアミノトランスフェラーゼ(ALT)、アルカリホスファターゼ(ALP)レベルが強く上昇した(図2)。
シクロデキストリン処理により、ASTおよびALTレベルは野生型レベルに著しく回復した(図2A、B)。一方、ALPレベルはシクロデキストリンの影響を受けなかった(図2C)。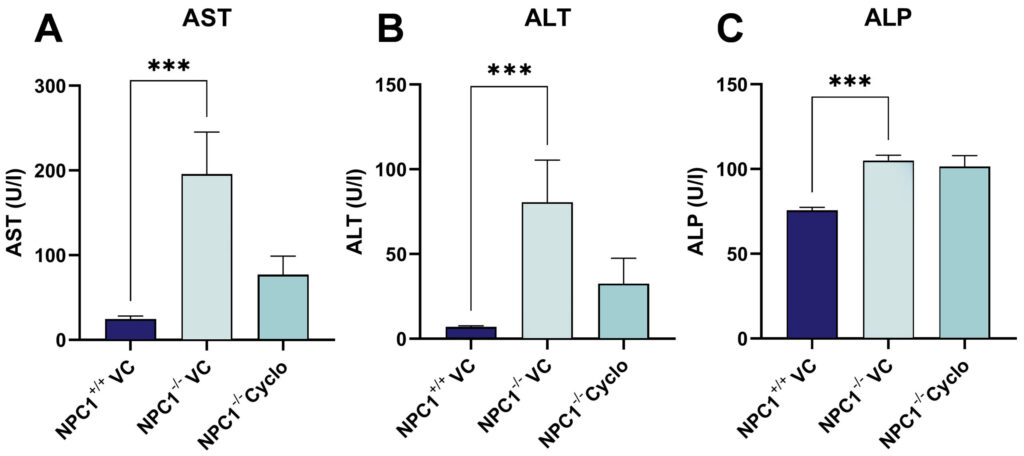 図2:肝酵素に対するシクロデキストリン処理の影響。 NPC1-/-および野生型動物(各群n = 6)をアスパラギン酸アミノトランスフェラーゼ(AST、
図2:肝酵素に対するシクロデキストリン処理の影響。 NPC1-/-および野生型動物(各群n = 6)をアスパラギン酸アミノトランスフェラーゼ(AST、
A)、アラニンアミノトランスフェラーゼ(ALT、
B)、アルカリホスファターゼ(ALP、
C)の血漿中濃度を分析した。 Kruskal-Wallis検定およびDunnの多重比較ポストホック検定(ASTおよびALT)または一元配置分散分析およびDunnettの多重比較検定(ALP);平均値+SEM;***p<0.001。
したがって、シクロデキストリンは、このライソゾーム貯蔵病に対するin vivoでの 有効性について新規化合物を評価するための貴重な参照化合物である。
シクロデキストリンは現在、NPC1欠損患者への使用がすでに試験されているため、シクロデキストリンを参照化合物として用いた前臨床試験の結果は、極めてトランスレーショナルな意義を持つことになる。
お問い合わせ次回のin vivoニーマン・ピック病試験におけるシクロデキストリンの使用についてご相談ください。









