AAV2 hA53T-α-syn 유도 마우스 모델
야생형 C57BL/6 마우스는 AAV2 hA53T-α-syn(A53T 돌연변이가 있는 인간 α-시누클레인)을 흑질에 일방적으로 1회 주사하여 동측 반구에서 hA53T-α-syn을 선택적으로 발현합니다.
AAV2 hA53T-α-syn 유도 생쥐의 가장 중요한 특징은 다음과 같습니다:
- 뚜렷한 뇌 영역에서 인간 A53T- α-시누클린의 발현
- 미세아교증
- 티로신 하이드 록실 라제 수치 감소
AAV2 hA53T-α-syn을 주입한 뇌의 조직학적 분석 결과, 주입된 뇌 반구의 흑질과 꼬리배엽에서 hA53T-α-syn 단백질 수치가 증가한 것으로 나타났습니다.
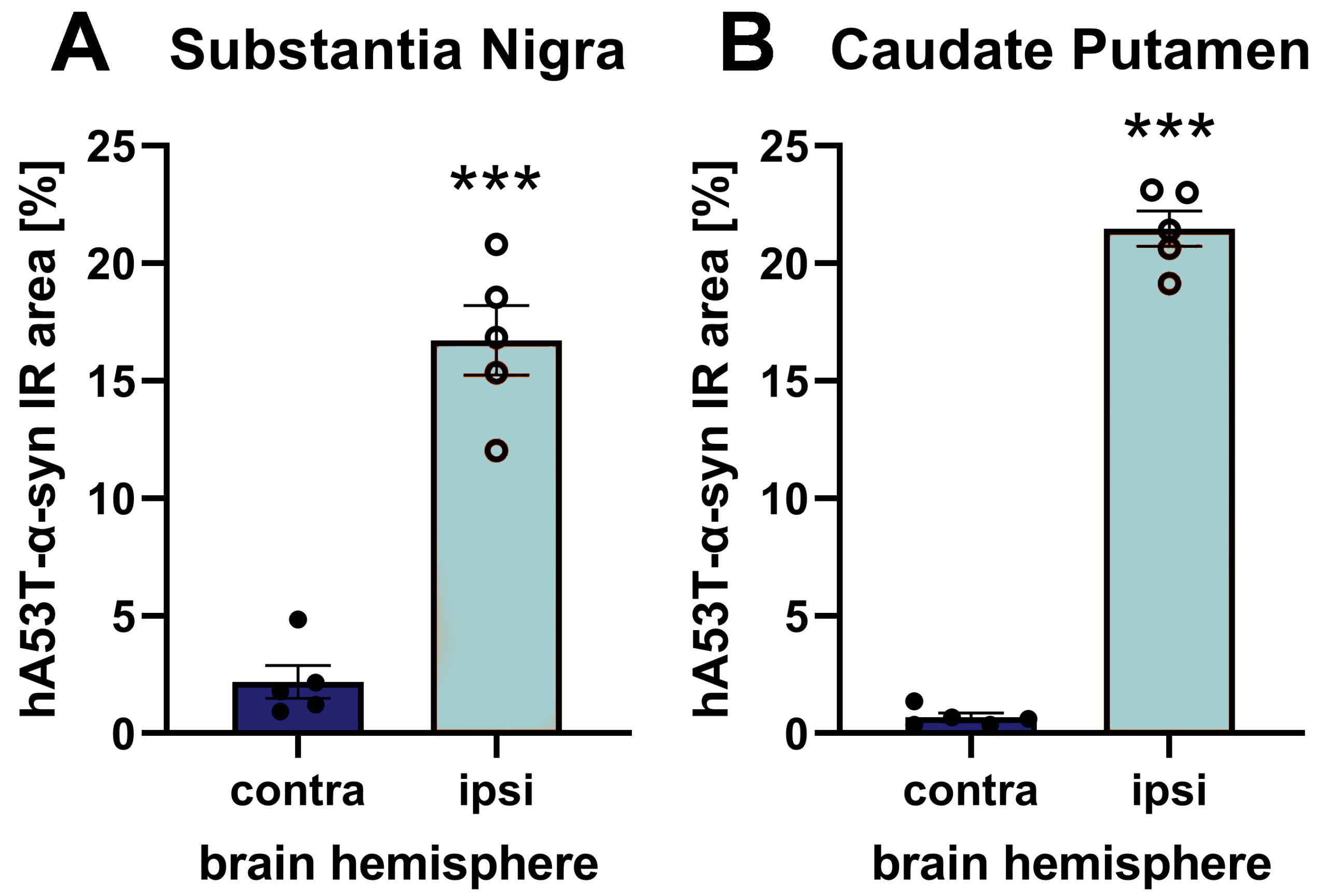
그림 1: 흑질 내 hA53T-α-syn 면역 반응 영역(IR) (A) 및 꼬리핵(caudate putamen) (B) 동측 반구의 흑질에 일측 AAV2 hA53T-α-syn을 주입한 후 반대편 및 동측 반구의 모습. 주사 9주 후 동물을 안락사시키고 인간 특이 α-syn 항체를 사용하여 뇌를 평가했습니다. n = 5 / 그룹; 짝을 이루지 않은 t-검정; 평균 ± SEM. ***p<0.001.
hA53T-α-syn 발현은 신경 염증의 마커로서 활성화된 미세아교세포를 증가시키고, 면역 형광 표지 정량화로 평가한 결과 주입된 흑질에서 티로신 수산화효소(TH) 수치가 크게 감소했습니다.

그림 2: Iba1 (A) 및 TH (B) 동측 반구의 흑질에 일측 AAV2 hA53T-α-syn을 주입한 후 반대편 및 동측 반구의 흑질에서 면역 반응 영역(IR). 동물은 주사 후 9주 후에 안락사시켰습니다. n = 5 / 그룹; 비쌍검정 t-검정; 평균 ± SEM. *p<0.05; **p<0.01.
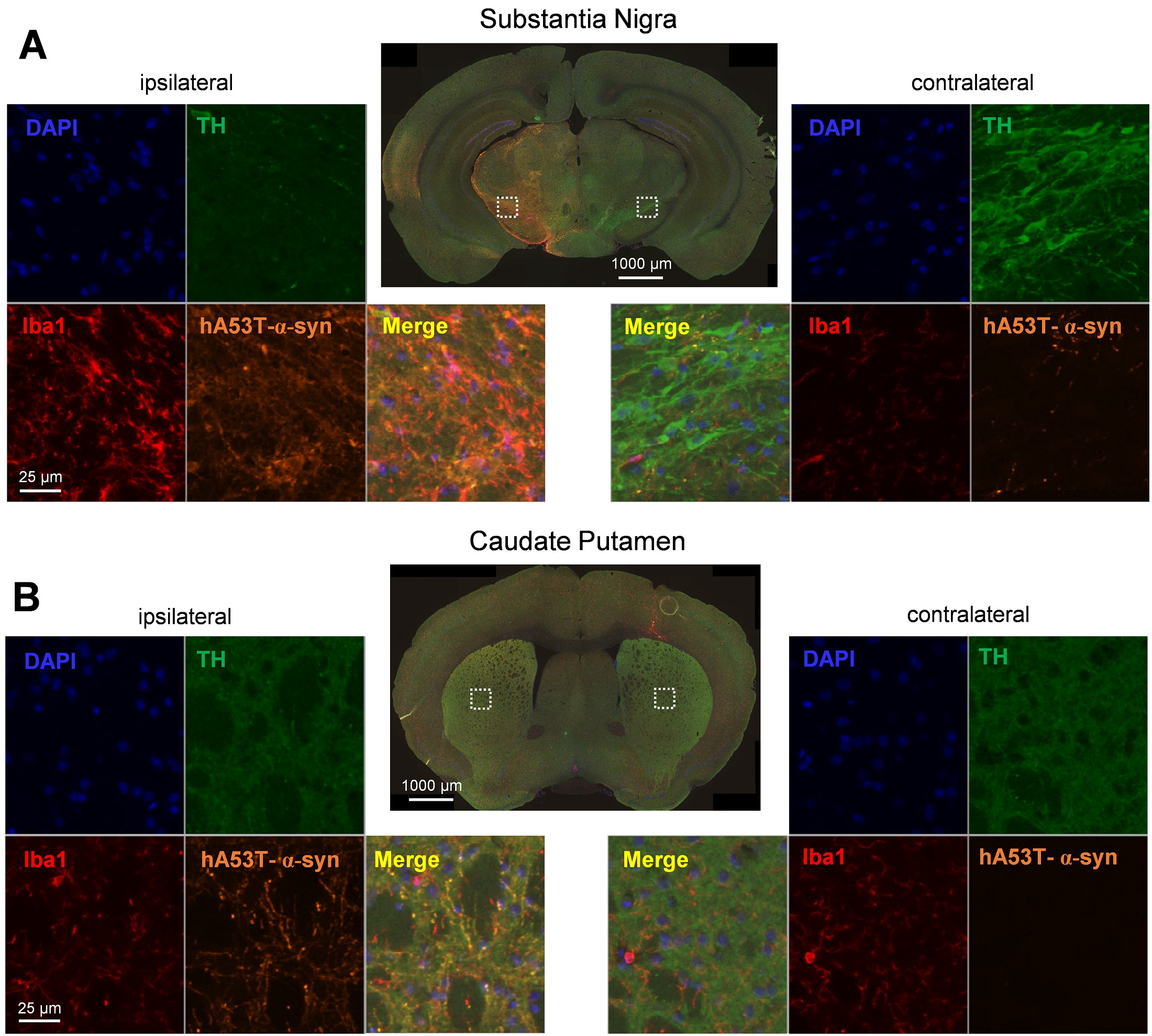
그림 3: 흑질의 ipsi-(왼쪽) 및 반대쪽(오른쪽) 반구에서 hA53T-α-syn, 티로신 하이드 록실 라제 (TH), Iba1 및 DAPI 라벨링의 대표 이미지입니다. (A) 및 꼬리핵과 꼬리핵 (B) 동측 반구의 흑질에 일측 AAV2 hA53T-α-syn을 주입한 후의 모습.
MPTP 유도 마우스 모델
피리딘 독소 1-메틸-4-페닐-1,2,3,6-테트라하이드로피리딘(MPTP)을 급성, 만성 또는 아만성으로 투여한 마우스는 두 개의 중뇌 구조인 흑질(SN)과 복측 피질(VTA)에서 상당한 수의 도파민 뉴런이 선택적으로 소실됩니다. SN에서 도파민 세포의 손실은 파킨슨병의 임상 상태를 모방하여 운동 기능 장애로 이어집니다.
마우스 VTA의 도파민성 손실은 파킨슨병과의 관련성은 알려지지 않았지만, 이러한 뉴런이 전두엽 피질로 투영되기 때문에 파킨슨병의 인지 결손에 기여할 수 있습니다.
MPTP에 감염된 마우스의 가장 중요한 특징은 다음과 같습니다:
- 활동 감소
- 흑질과 VTA에서 도파민 신경세포의 손실
- 꼬리말샘에서 DOPAC 및 HVA 감소
- 흑질 흑질에서 TH 감소
치료 이틀 후 MPTP를 투여한 생쥐의 행동 분석 결과, 가짜 투여 동물에 비해 활동이 현저히 감소했습니다(그림 1).
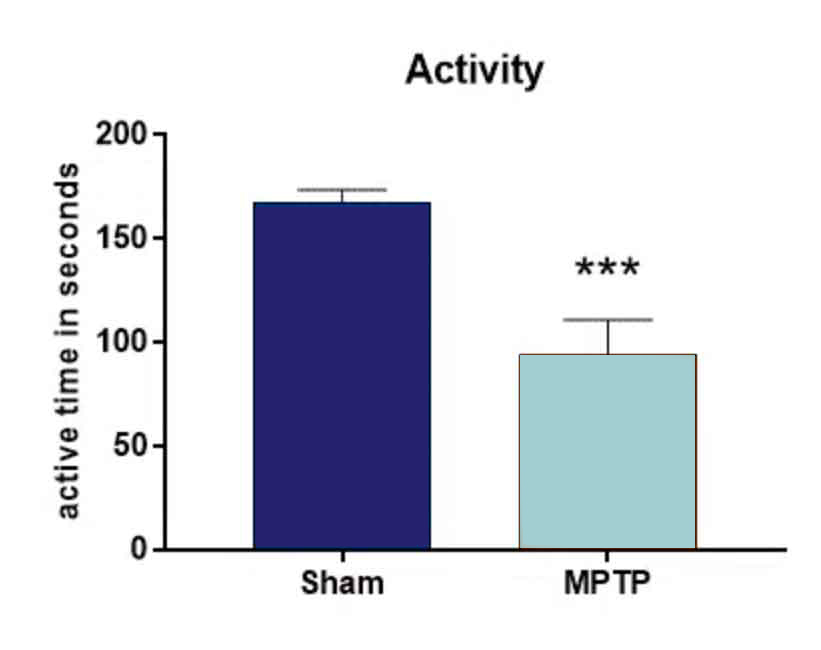
그림 1: 오픈 필드 테스트. 동물에게 하루에 20 mg/kg MPTP 또는 차량을 4 회 주사했습니다. 치료 이틀 후, 동물들을 야외 실험에서 활동성을 테스트했습니다. n = 그룹당 9-10; 비쌍검정 t-검정; 평균 + SEM. ***p<0.001.
MPTP를 주입한 후 흑질에서 티로신 하이드 록실 라제 (TH)를 정량화한 결과, 가짜 주입 대조군 마우스에 비해 TH 수치가 현저히 감소했습니다 (그림 2).
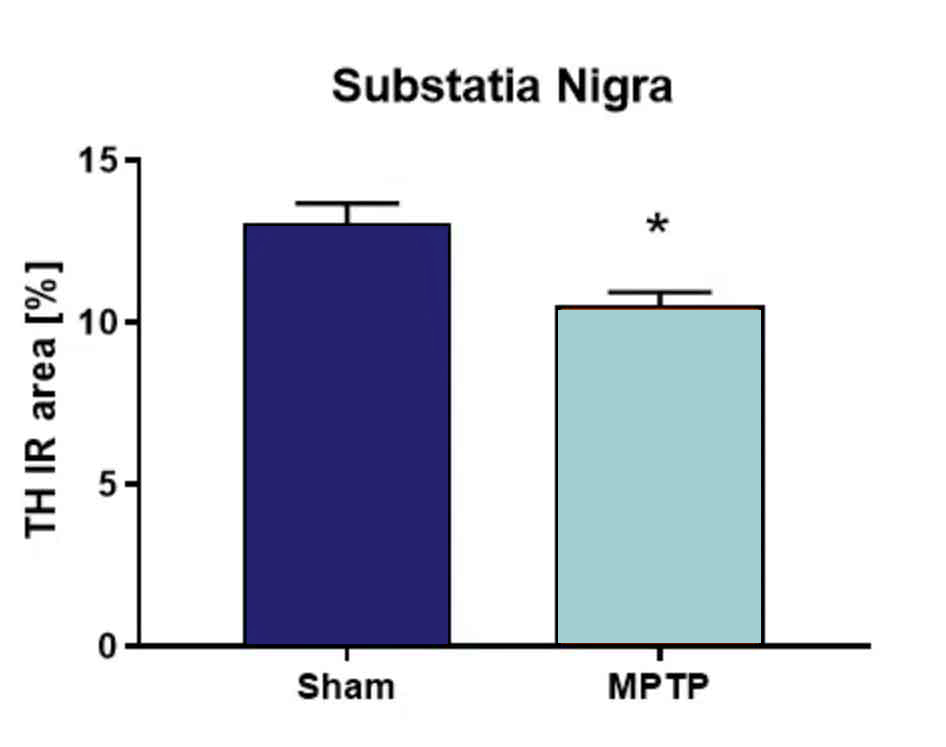
그림 2. MPTP 병변 후 흑질에서 티로신 하이드 록실 라제 (TH)의 정량화. 동물에게 1일에 20 mg/kg MPTP 또는 차량을 4회 주사했습니다. 치료 6일 후, 동물을 희생시키고 흑질에서 TH 수치를 분석했습니다. n = 그룹당 3-5; 비쌍검정 t-검정; 평균 + SEM. *p<0.05.
따라서 MPTP로 처리된 마우스는 운동 결핍과 도파민 신경세포의 손실, 그리고 이러한 매개변수에 대한 약물의 가능한 영향을 연구하기에 적합한 모델입니다.
6-OHDA 유도 마우스 모델
설치류 뇌의 특정 뇌 영역에 일방적으로 주입하면 6-OHDA는 산화 스트레스에 의해 카테콜아민성 뉴런의 손상을 유도합니다. 용량과 주사 부위에 따라 도파민 신경세포의 심각한 손실로 이어지며, 이는 종종 티로신 하이드 록실 라제 (TH) 면역 반응성의 손실로 입증됩니다. 이 병리학은 PD의 주요 특징 중 하나인 중중격계의 도파민 결핍을 모방합니다. 따라서 6-OHDA 병변은 35년 이상 PD의 모델로 사용되어 왔습니다.
6-OHDA 주사 부위는 내측 전뇌 다발, 선조체의 여러 부위(단일 또는 다중 주사 부위) 또는 흑질입니다.
6-OHDA를 주입한 쥐의 가장 중요한 특징은 다음과 같습니다:
- 실린더 및 회전 테스트의 측면 동작 결함
- 꼬리말단의 티로신 하이드 록실 라제 수치 감소
- 꼬리뼈의 DAT 수치 감소
- 꼬리말단의 성상세포증과 활성화된 미세아교세포
내측 전뇌 다발(MFB)의 일측 6-OHDA 병변은 실린더 및 회전 테스트를 통해 분석한 결과 병변을 배치한 지 3주 후에 강한 측면 행동 결손을 초래합니다(그림 1).
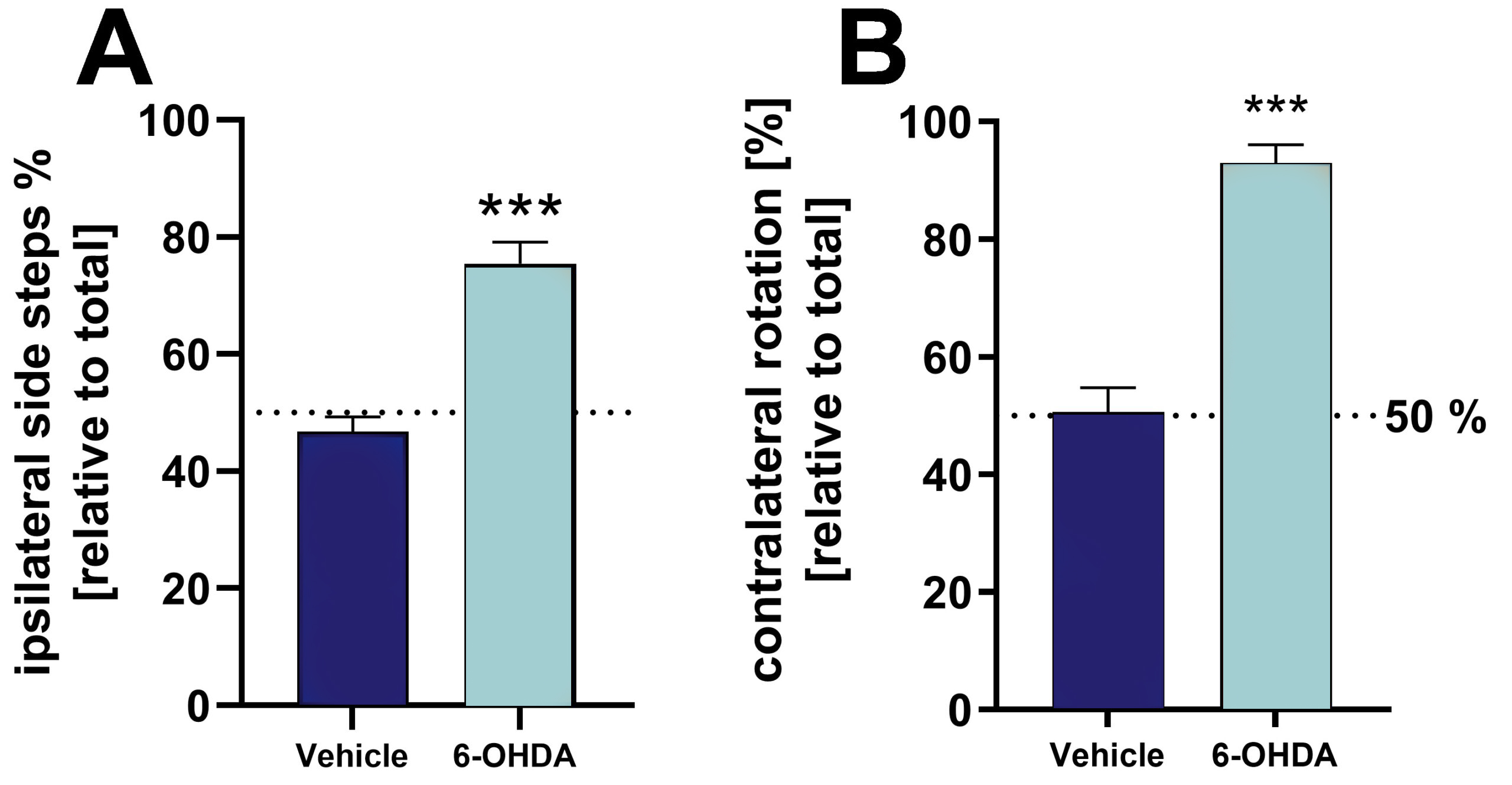
그림 1: 6-OHDA 주입 쥐와 차량 주입 쥐의 실린더 및 회전 테스트를 통한 6-OHDA 병변의 검증. A: 실린더 테스트에서 총 측면 스텝 대비 동측 측면 스텝 [%]. B: 회전 테스트에서 상대적 반대측 회전. 시험은 6-OHDA 병변 3주 후에 실시했습니다. 회전 테스트의 경우, 동물에게 아포모르핀을 투여하여 회전 행동을 유도했습니다. 평균 + SEM. 비쌍검정 t-검정. n = 8(차량) 및 19(6-OHDA); ***p<0.001.
3가지 농도의 L-DOPA/벤데라지드 처리는 실린더 테스트에서 관찰된 측면 행동 효과를 역전시킬 수 있습니다(그림 2A). 회전 테스트에서 6-OHDA 쥐를 추가로 평가한 결과, 반대쪽 회전의 상대적 횟수는 다른 L-DOPA 농도에 영향을 받지 않는 것으로 나타났습니다(그림 2B).
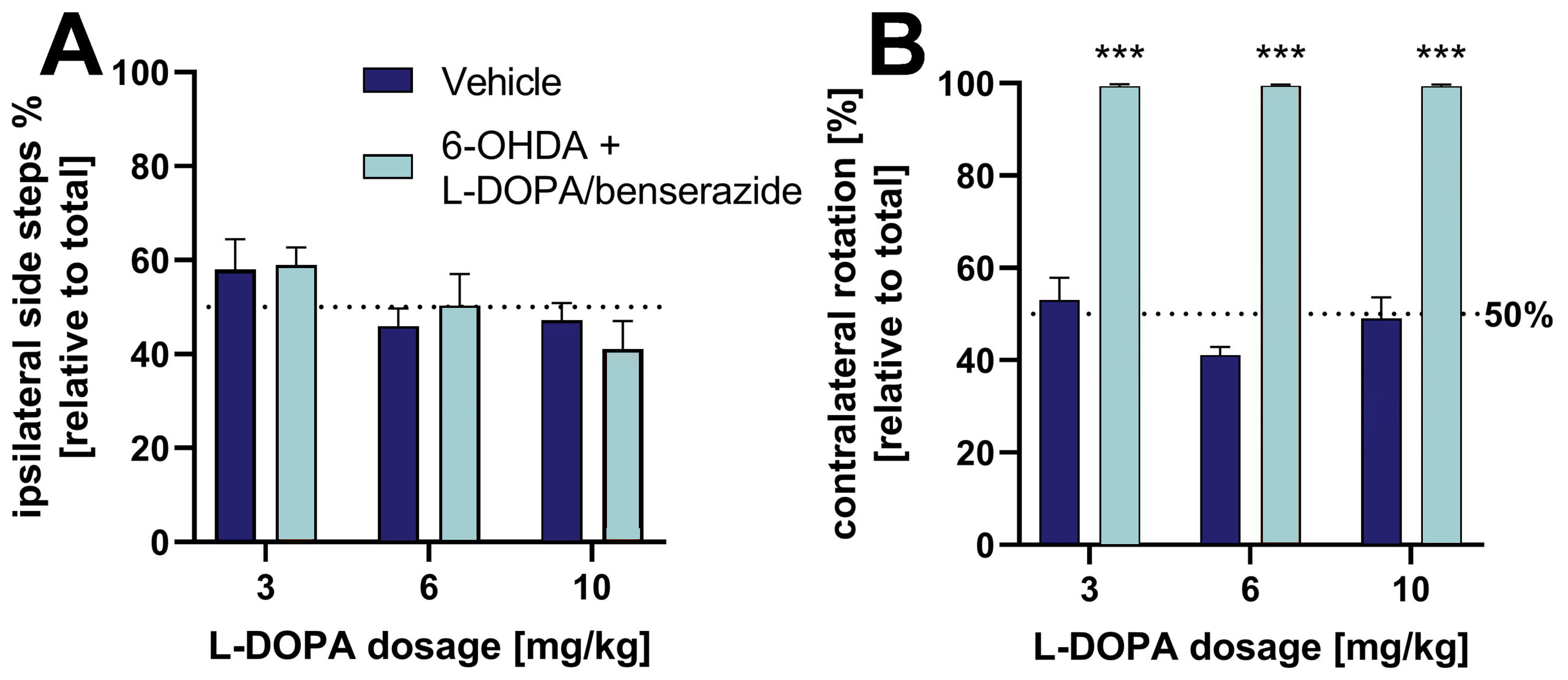
그림 2: 실린더 및 회전 테스트에서 6-OHDA를 투여한 쥐의 측면 행동에 대한 L-DOPA/벤데라자이드의 효과. A: 실린더 테스트에서 총 측면 스텝 대비 동측 측면 스텝 [%]. B: 회전 테스트에서 상대적인 반대쪽 회전. 회전 테스트의 경우, 동물에게 아포모르핀을 투여하여 회전 행동을 유도했습니다. 평균 + SEM. 투키와 시닥의 사후 검증을 사용한 이원 분산 분석. n = 8(모든 차량 그룹) 및 16(모든 6-OHDA 그룹); ***p<0.001.
MFB의 6-OHDA 병변 5주 후 꼬리배엽에서 티로신 하이드 록실 라제 (TH) 및 DAT 양성 면역 반응 영역 (IR)의 조직 학적 평가는 뇌의 병변 측에서 TH 및 DAT 수준이 크게 감소한 것으로 나타났습니다 (그림 3A, B). MFB의 6-OHDA 병변 후 꼬리배엽의 아교섬유아교산단백질(GFAP)- 및 Iba-1 양성 면역 반응 영역의 조직학적 평가는 병변이 있는 쪽 뇌의 꼬리배엽에서 GFAP 및 Iba-1 수치가 증가한 것으로 나타났습니다(그림 3C, D). 이러한 데이터는 6-ODHA 병변이 성상세포증과 활성화된 미세아교세포에서 볼 수 있듯이 신경 염증을 유도한다는 것을 보여줍니다.
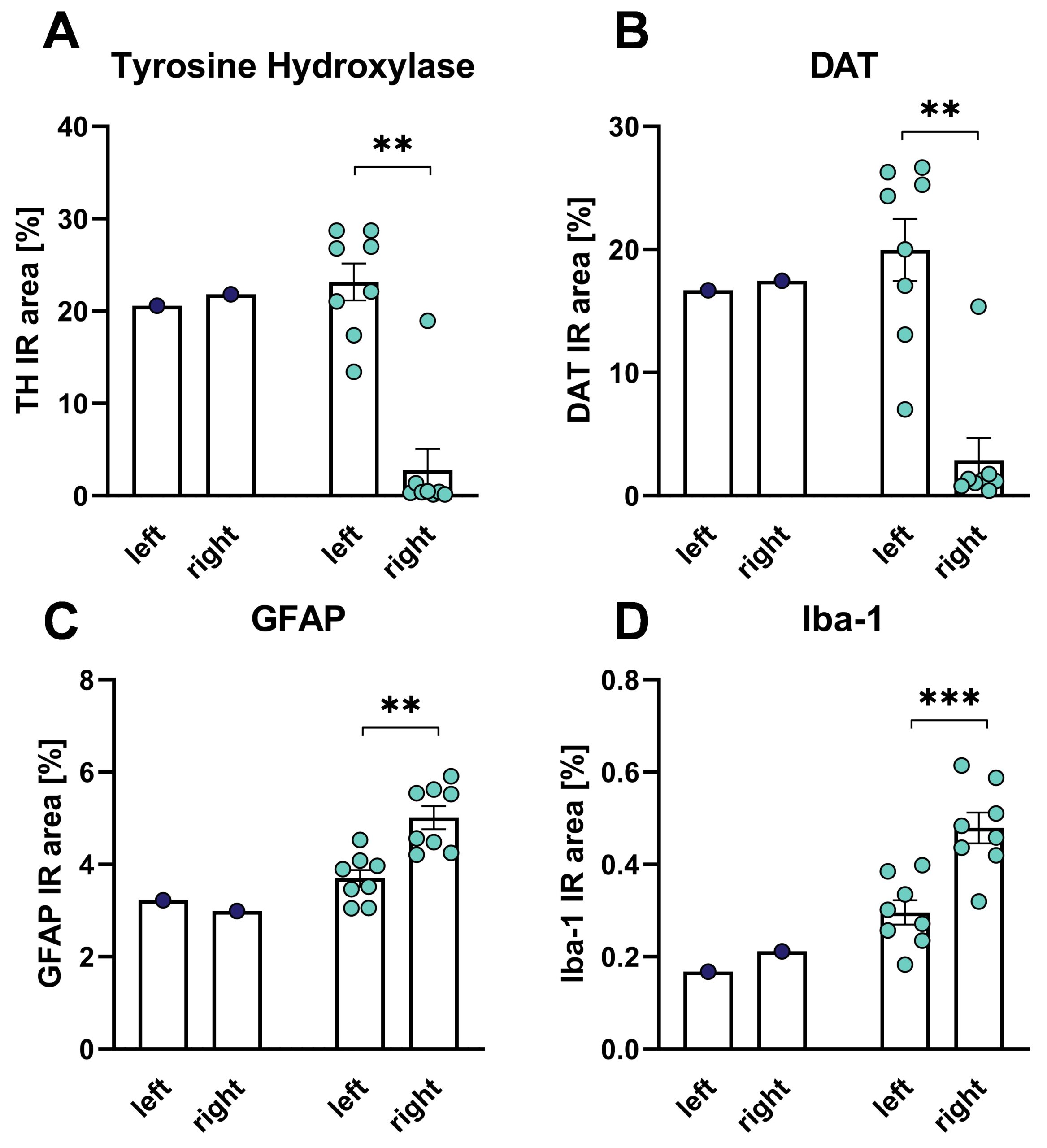
그림 3: 티로신 하이드 록실 라제 (TH)에 대한 꼬리 퍼타멘의 조직 학적 평가, A), DAT (B), GFAP (C) 및 Iba-1 (D) 쥐에서 MFB의 6-OHDA 병변 후 적외선 영역. 6-OHDA 그룹만을 대상으로 한 비쌍검정 t-검정. 6-OHDA: n = 8; 차량: n = 1. 평균 + SEM. **p<0.01, ***p<0.001. 왼쪽: 치료하지 않은 쪽; 오른쪽: 치료한 쪽. 파란색: 차량 그룹, 주황색: 6-OHDA 그룹.
할로페리돌-유도성 탈력증
진전증은 파킨슨병, 간질, 카타토니아에서 관찰될 수 있는 신경 질환이지만 정신분열증 치료제와 같은 처방된 약물에 대한 부작용으로도 나타날 수 있습니다. 카타토니아는 신체의 경직과 함께 감각과 의식을 잃고 발작을 일으키는 것이 특징입니다. 도파민 D2 수용체 길항제인 할로페리돌로 쥐를 치료하면 전형적인 증상을 모방하여 몇 시간 동안 급성으로 카탈렙시를 유발할 수 있습니다.
Sprague Dawley 쥐에게 1 mg/kg 할로페리돌을 피하 주사합니다. 30분 후, 탈력증을 측정하고 추가로 탈력증의 전체 스펙트럼을 보이는 동물에게 양성 화합물 또는 매개체를 경구 투여합니다. 약물 투여 후 여러 시점에서 동물의 탈력증 여부를 다시 검사할 수 있습니다.
할로페리돌을 투여한 쥐의 가장 중요한 특징은 다음과 같습니다:
- 의식 상실
- 본체 강성
카탈렙시는 쥐의 앞다리를 8cm 높이의 수평 막대 위에 가볍게 올려놓아 평가할 수 있으며, 카탈렙시는 동물이 움직이지 않는 시간으로 측정할 수 있습니다. 120초의 컷오프 시간이 사용됩니다.
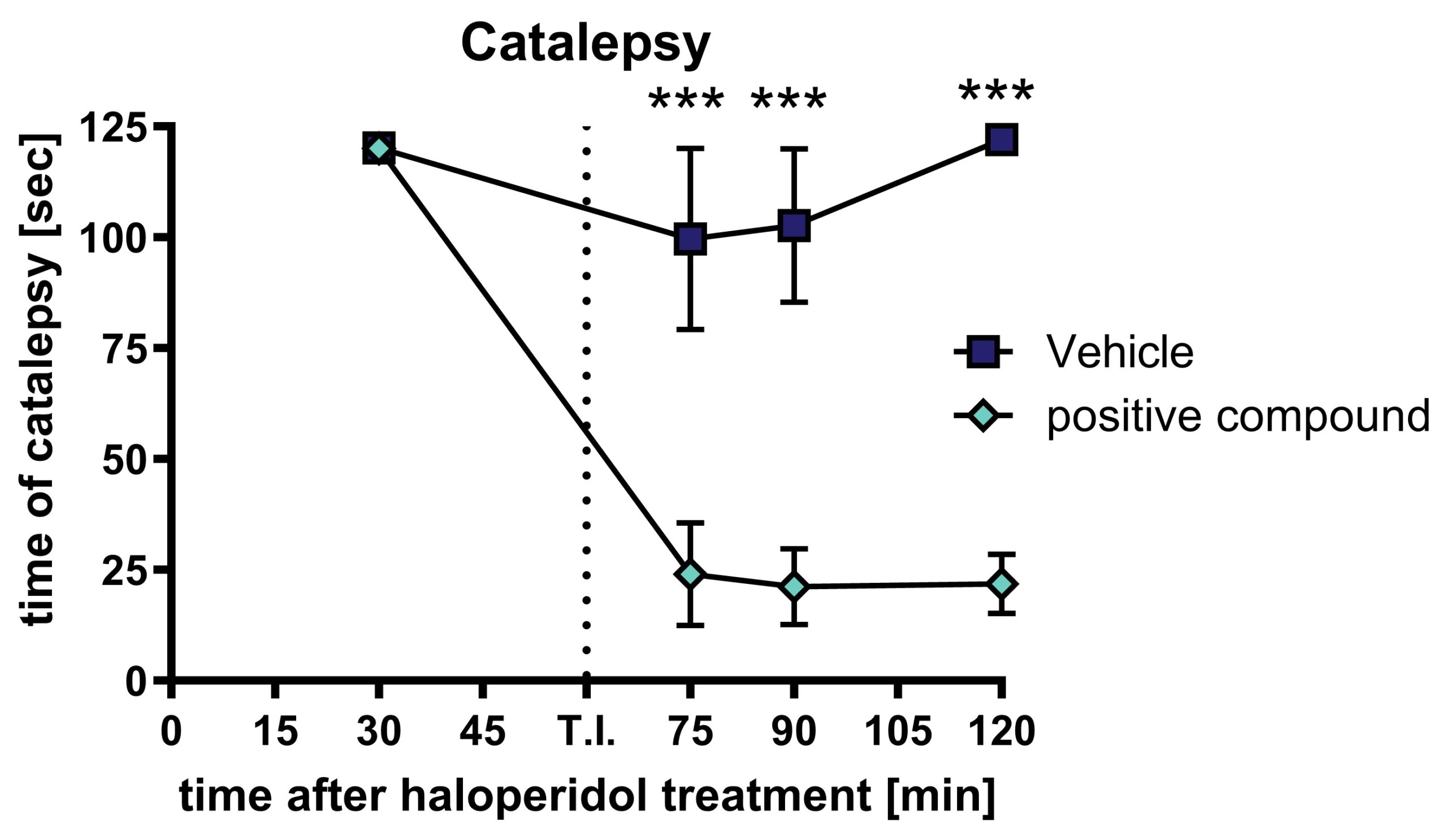
그림 1: 양성 화합물로 치료한 후 할로페리돌로 유발된 탈력증: 1 mg/kg 할로페리돌을 피하 처리한 후 양성 화합물을 경구 처리한 후 동물이 경직된 시간을 보냈습니다. 동물들은 반복적으로 탈력증 검사를 받았습니다. n = 10. 평균 ± SEM. 본페로니의 반복 측정 사후 검증을 사용한 이원 분산 분석. ***p<0.001. T.I.: 테스트 항목/양성 화합물.
Scanox는 모든 유도 PD 모델에 대한 맞춤형 연구 설계를 제공하며, 고객의 특별한 관심사에 유연하게 대응할 수 있습니다. 또한 연구 설계에 대한 조언과 제안도 기꺼이 해드립니다. 모든 유도 모델은 치료 직후에 관련 파킨슨병(PD) 표현형을 나타냅니다. 따라서 PD 연구의 처리 시간이 놀라울 정도로 빨라집니다. 또한, 차량에 주입된 야생형 마우스 및/또는 주입된 동물의 반대편 반구는 적절한 연구 설계에 필요한 대조군 역할을 할 수 있습니다.
유도된 PD 동물 모델에서 귀사의 화합물의 효능을 평가해 드립니다! 가장 일반적인 판독 결과는 모델에 따라 다르며 다음과 같습니다:
