바이러스 주사는 신경 퇴행성 및 희귀 질환 연구 분야에서 점점 더 없어서는 안 될 필수 요소가 되고 있습니다. 이 방법을 사용하면 해마, 피질, 선조체, 심실 또는 거의 모든 다른 뇌 영역에 정위 주사를 통해 특정 뇌 영역에서 표적 단백질을 발현하거나 억제할 수 있으며, 표적 단백질의 cDNA 또는 shRNA를 발현하는 바이러스 입자를 정맥 주사하여 보다 체계적으로 표적 단백질을 발현하거나 억제할 수 있습니다.
AAALAC 인증을 받은 Scantox의 동물 시설은 렌티, 아데노 및 아데노 관련(AAV) 바이러스 입자 주사를 포함한 마우스 및 쥐 실험을 위한 생물안전 레벨 2(BSL2) 실험실을 유지하고 있습니다.
이 방법은 생쥐와 쥐에서 알츠하이머, 파킨슨병, 타우병증, 근위축성 측삭 경화증, 여러 리소좀 저장 질환, 자폐 스펙트럼 장애 등과 같은 특정 질환에 특이적인 단백질을 유도하거나 억제하는 데 사용할 수 있습니다. 따라서 이 방법은 유전자 치료 접근법에도 큰 관련이 있습니다.
Scantox에서 일반적으로 사용되는 바이러스 유발 설치류 모델은 다음과 같습니다:
- AAV2 hA53T α-시누클레인 유발 파킨슨병
- AAV9 TDP-43에 의한 근위축성 측삭 경화증
- AAV9 타우 P301L 유도 타우 시딩(아래 참조)
타우 시딩
알츠하이머 또는 기타 인지 질환의 유발 또는 치료를 위한 특정 바이러스의 효과를 분석하기 위해 마우스 내후각 피질(ERC)에 주사를 실시할 수 있습니다.
여기서 소개하는 시딩 연구에서는 AAV9 타우 P301L을 APPSL 생쥐의 해마에 주입한 결과, 주입 1개월 후 해마에 타우가 퍼지는 것을 관찰했습니다(그림 1).
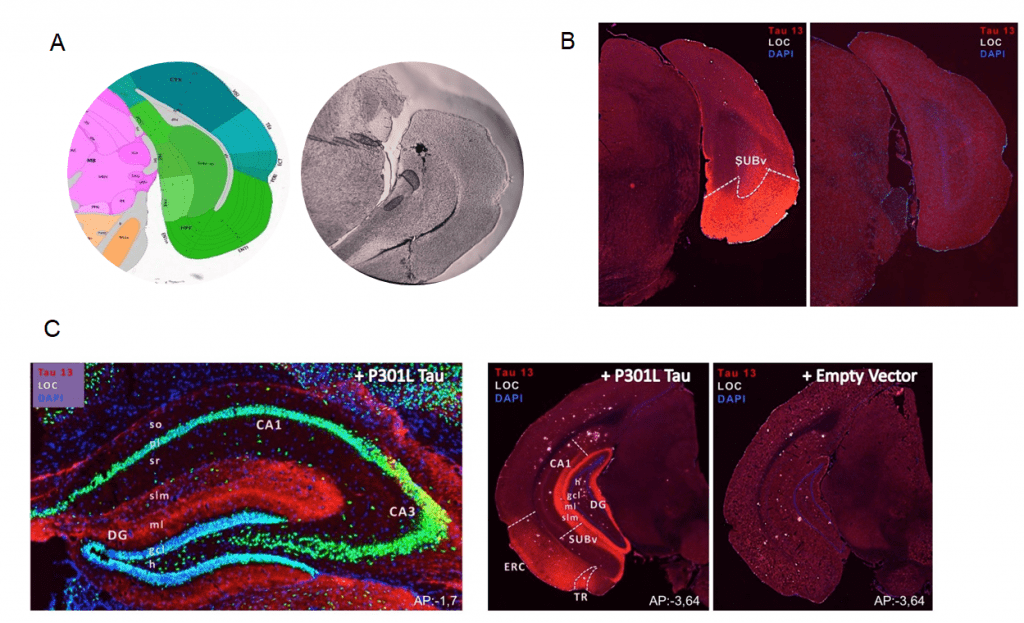
그림 1: 인간 타우 P301L 유전자 또는 빈 벡터를 가진 혈청형 9(AAV9)의 재조합 아데노 관련 바이러스 입자를 3개월 수컷 APPSL 마우스의 ERC에 뇌내 주입했습니다. A: ERC에 잉크를 주입하여 주사 부위를 확인한 모습. B: AAV9 타우 P301L 바이러스 주입 후 ERC 내 타우 발현. C: APPSL 마우스의 ERC에 AAV9 타우 P301L 주입 후 해마로 타우가 확산되는 모습. 모든 분석은 바이러스 주입 후 1개월 후에 수행되었습니다.
바이러스 주입을 통한 단백질 유도는 대부분의 신경 퇴행성 및 리소좀 저장 질환 모델에 적용할 수 있는 다목적 방법이며, 단백질 억제는 생체 내 단백질의 기능 또는 유전자 치료 접근법의 효능을 평가하는 데 유용합니다. 연구 분야에 이 방법을 적용할 수 있는지 알아보려면 지금 바로 문의하세요.
SCANTOX는 바이러스 유발 설치류 모델을 위한 맞춤형 연구 설계를 제공하며, 고객의 특별한 관심사를 수용할 수 있도록 유연하게 대응합니다. 또한 연구 설계에 대한 조언과 제안도 기꺼이 해드립니다. 바이러스로 유도된 모델은 치료 직후에 관련 질병 표현형을 보이는 경우가 많습니다. 따라서 연구 처리 시간이 놀라울 정도로 빨라집니다. 또한, 가짜/차량 치료 마우스는 적절한 연구 설계에 필요한 대조군 역할을 할 수 있습니다.
바이러스로 유도된 설치류 모델에서 귀사의 화합물의 효능을 평가해 드립니다! 가장 일반적인 판독 결과는 모델에 따라 다르며 다음과 같습니다:
이러한 관련 주제에도 관심이 있을 수 있습니다:
