신경 퇴행성 질환에서 뇌 대식세포인 미세아교세포의 중요성은 잘 알려져 있으며, 따라서 이 세포는 새로운 약리학적 개입을 위한 표적으로 자주 사용됩니다.
SCANTOX에서 생쥐의 출생 후 초기 미세아교세포를 분리하는 것은 이 특정 세포 유형의 시험관 내 분석을 위해 잘 확립되고 표준화된 방법입니다.
또한 최근에는 자기 세포 분류(MACS)를 통해 성체 생쥐에서 미세아교세포를 분리하는 방법을 확립했습니다.
형질전환 생쥐 또는 화합물 치료를 받은 생쥐의 성체 뇌에서 순수한 미세아교세포 분획을 생성하면 치료의 효능을 평가할 수 있는 다양한 새로운 가능성이 열립니다.
유전자 발현, 바이오마커 또는 이러한 세포의 추가 배양 및 자극에 대한 세포 유형별 분석을 통해 해결되지 않은 질문에 답할 수 있습니다.
나머지 세포가 모두 포함된 분획(흐름 통과, FT)과 비교한 미세아교세포 분획의 순도는 미세아교세포 마커 Itgam(CD11b)과 성상세포 마커 GFAP의 mRNA 분석을 통해 평가되었습니다(그림 1).
그 결과 미세아교세포 분획에서 Itgam 양성 세포가 FT에 비해 강하게 농축되어 있으며(그림 1A), 미세아교세포 분획에서 GFAP 발현이 없거나 매우 낮은 오염도를 보였습니다(그림 1B).
또한, 세포 유형별 mRNA 발현의 예로서, 비형질 전환 생쥐와 비교하여 5xFAD 생쥐에서 분리한 미세아교세포에서 RT-PCR을 통한 IL-6 및 MYD88 분석을 수행했습니다(그림 2).
흥미롭게도, IL-6 발현의 높은 증가는 노화된 5xFAD 마우스의 미세아교세포에서 MYD88 발현 수준의 감소를 동반합니다. 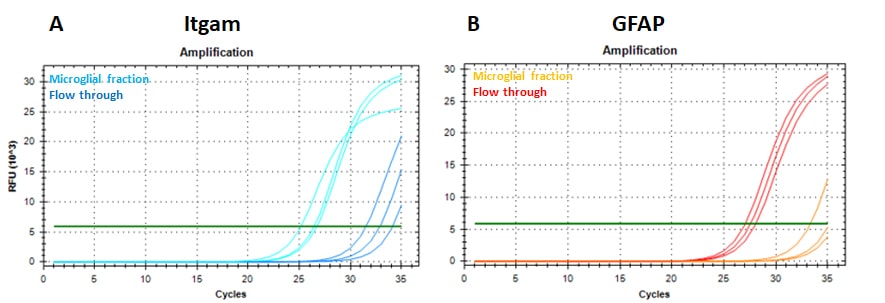
그림 1: RT-PCR 증폭 그래프
(A) 잇감 및
(B) 생후 9.5개월 된 생쥐의 뇌에서 분리한 3개의 미세아교세포 및 분획을 통한 GFAP SYBR 녹색 신호. 그래프는 사이클당 SYBR 녹색 신호의 상대 형광 단위(RFU)를 보여줍니다. 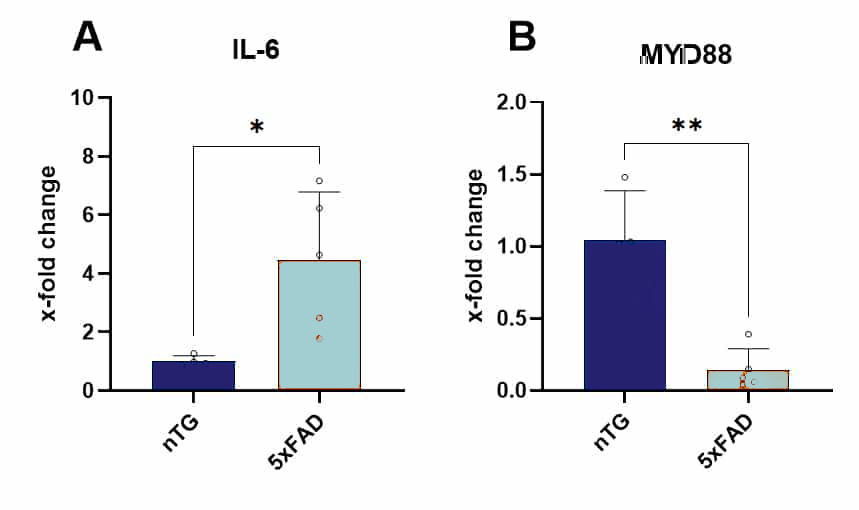
그림 2: 생후 9.5개월에 비형질전환(nTG) 및 5xFAD 마우스 뇌의 미세아교세포 분획에서 IL-6 및 MYD88 mRNA 발현 수준. 데이터는 nTG 마우스와 비교하여 x배 변화로 표시되며 막대 그래프 + SD(그룹당 n=4-5)로 표시됩니다.
통계 분석: 비쌍검정 t-검정.
*p<0.05; **p<0.01. 생체 내 모델의 미세아교세포를 분리하려면 지금 바로 문의하세요!